Trong thiên nhiên manganesium là nguyên tố tương đối phổ biến, đứng thứ ba trong các kim loại chuyển tiếp, chỉ sau Fe và Ti. Các khoáng vật chính của manganesium là hausmanite (Mn3O4), pyrolusite (MnO2), braunite (Mn2O3) và manganite (MnOOH). Manganesium tồn tại ở rất nhiều trạng thái oxi hoá khác nhau từ +2 tới +7.
Phản ứng nào sau đây không có sự thay đổi số oxi hoá của nguyên tố Mn?
A. MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
B. Mn + O2 -> MnO2
C. 2HCl + MnO -> MnCl2 + H2O
D. 6KI + 2KMnO4 + 4H2O -> 3I2 + 2MnO2 + 8KOH
Xác định số oxi hóa của các nguyên tử Mn trong phản ứng
A. \(\mathop {Mn}\limits^{ + 4} {O_2} + 4HCl \to \mathop {Mn}\limits^{ + 2} C{l_2} + C{l_2} + 2{H_2}O\)
B. \(\mathop {Mn}\limits^0 + {O_2} \to \mathop {Mn}\limits^{ + 4} {O_2}\)
C. \(2HCl + \mathop {Mn}\limits^{ + 2} O \to \mathop {Mn}\limits^{ + 2} C{l_2} + {H_2}O\)
D. \(6KI + 2K\mathop {Mn}\limits^{ + 7} {O_4} + 4{H_2}O \to 3{I_2} + 2\mathop {Mn}\limits^{ + 4} {O_2} + 8KOH\)
=> Đáp án: C

Các bài tập cùng chuyên đề
Xác định số oxi hóa của nguyên tử Fe và S trong các chất sau:
a) Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4.
b) S, H2S, SO2, SO3, H2SO4, Na2SO3.
Xác định chất oxi hóa, chất khử
Chuẩn bị: đinh sắt, dung dịch CuSO4, dung dịch H2SO4 loãng, ống nghiệm.
Thực hiện:
Thí nghiệm 1: Cho đinh sắt vào ống nghiệm đựng dung dịch CuSO4.
Thí nghiệm 2: Cho đinh sắt vào ống nghiệm đựng dung dịch H2SO4.
Quan sát hiện tượng và trả lời câu hỏi:
1. Viết quá trình oxi hóa, quá trình khử.
2. Xác định chất oxi hóa, chất khử trong hai phản ứng trên.
Xác định số oxi hóa của mỗi nguyên tử nguyên tố trong các hợp chất ion Al2O3, CaF2.
Xác định số oxi hóa của mỗi nguyên tử trong hợp chất sau: N = O, CH4.
Dựa theo quy tắc octet, giải thích vì sao số oxi hóa của O là -2, của kim loại nhóm IA là +1, của kim loại nhóm IIA là +2 và của Al là +3.
Xác định số oxi hóa của mỗi nguyên tử trong của hợp chất: Fe2O3, Na2CO3, KAl(SO4)2
Xác định số oxi hóa của mỗi nguyên tử trong các ion: NO3-, NH4+, MnO4-.
Xác định số oxi hóa của mỗi nguyên tố trong NH3 theo cách 2.
Dựa vào độ âm điện, giải thích vì sao công thức ion giả định của OF2 là F-O2+F- mà không phải là F+O2-F+.
Xác định số oxi hóa của các nguyên tử trong phản ứng (1), (2). Cho biết nguyên tố nào có sự thay đổi số oxi hóa.
Nguyên tố Cl thể hiện bao nhiêu số oxi hóa trong phản ứng (3)?
Xác định số oxi hóa của mỗi nguyên tử trong các phân tử và ion sau đây:
a) H2SO3
b) Al(OH)4-
c) NaAlH4
d) NO2-
Quan sát Hình 12.1, hãy viết quá trình nhường và nhận electron trong phản ứng giữa magnesium và oxygen
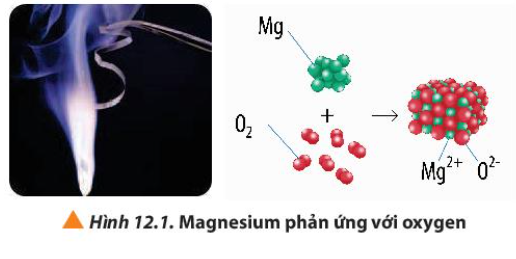
Quan sát Hình 12.2a, hydrogen cháy trong chlorine với ngọn lửa sáng, tạo hợp chất hydrogen chlorine (HCl). Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl (Hình 12.2b), hãy xác định điện tích của các nguyên tử trong phân tử HCl

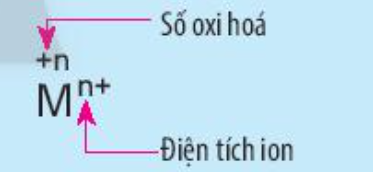
Nêu điểm khác nhau giữa kí hiệu số oxi hóa và kí hiệu điện tích của ion M trong hình sau:
Dự đoán số oxi hóa của các nguyên tử trong nhóm IA, IIA, IIIA trong các hợp chất. Giải thích
Magnetite là khoáng vật sắt từ có hàm lượng sắt cao nhất được dùng trong ngành luyện gang, thép, với công thức hóa học là Fe3O4 
Hãy xác định số oxi hóa của nguyên tử Fe trong hợp chất trên
Hãy nhận xét và giải thích sự thay đổi số oxi hóa của các nguyên tử trong chất oxi hóa và chất khử trước và sau phản ứng
Tính số oxi hóa của nguyên tử có đánh dấu * trong các chất và ion dưới đây

Xác định số oxi hoá của các nguyên tố trong các chất và ion sau:
a) Fe, N2, SO3, H2SO4, CuS, Cu2S, Na2O2, H3AsO4.
b) Br2, O3, HClO3, KClO4, NaClO, NH4NO3, N2O, NaNO2.
c) Br-, PO43-, MnO4-, ClO3-, H2PO4-, SO42-, NH4+.
d) MnO2, K2MnO4, K2Cr2O7, K2CrO4, Cr2(SO4)3, NaCrO2.
e) FeS2, FeS, FeO, Fe2O3, Fe3O4, FexOy.
Trong thiên nhiên manganesium là nguyên tố tương đối phổ biến, đứng thứ ba trong các kim loại chuyển tiếp, chỉ sau Fe và Ti. Các khoáng vật chính của manganesium là hausmanite (Mn3O4), pyrolusite (MnO2), braunite (Mn2O3) và manganite (MnOOH). Manganesium tồn tại ở rất nhiều trạng thái oxi hoá khác nhau từ +2 tới +7.
Cho các chất sau: Mn, MnO2, MnCl2, KMnO4 Số oxi hoá của nguyên tố Mn trong các chất lần lượt là
A. 2, -2, -4, +8.
B. 0, +4, +2, +7.
C. 0, +4, -2, +7.
D. 0, +2, -4, -7.
Dấu hiệu đề nhận ra phản ứng là phản ứng oxi hoá – khử dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A. Số mol.
B. Số oxi hoá.
C. Số khối.
D. Số proton.
Số oxi hoá của nguyên tử S trong hợp chất SO2 là
A. +2.
B. +4.
C. +6.
D. -1.
Magnetite là một loại sắt oxide có công thức Fe3O4 (còn gọi là oxide sắt từ). Chất này được coi là hỗn hợp của hai oxide. Tìm hiểu và xác định số oxi hóa của từng nguyên tử Fe trong magnetite.
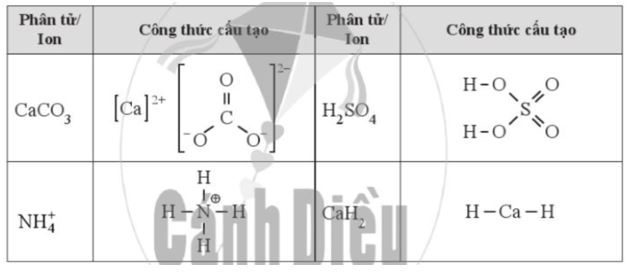
Dựa vào công thức cấu tạo, hãy xác định số oxi hóa của mỗi nguyên tố trong các hợp chất sau:
: a) Xác định số oxi hoá của mỗi nguyên tử trong các chất hoá học hoặc các ion sau: NO3-; H2PO4-; CaHAsO4; Mg2TiO4.
b) Ghép phân tử/ ion ở cột A với nhóm số oxi hoá của các nguyên tử trong phân tử/ ion ở cột B cho phù hợp.
|
Cột A Phân tử/ion |
Cột B Số oxi hoá của các nguyên tử trong phân tử/ion (lần lượt theo thự tự như trong phân tử/ion |
|
a) SbCl5 |
1. (-3; +1) |
|
b) BrO3- |
2. (+5; -1) |
|
c) Na2O2 |
3. (+1; -2) |
|
d) Na2S |
4. (+1; -1) |
|
e) NH4+ |
5. (+5; -2) |
|
6. (-1; +2) |
Số oxi hoá của Cl trong các chất NaOCl, NaClO2, NaClO3, NaClO4 lần lượt là:
A. -1, +3, +5, +7. B. +1, -3, +5, -2.
C. +1, +3, +5, +7. D. +1, +3, -5, +7.
Số oxi hoá của carbon và oxygen trong C2O42- lần lượt là:
A. +3, -2. B. +4, -2. C. +1, -3. D. +3, -6.
Số oxi hoá của chromium (Cr) trong Na2CrO4 là
A. -2. B. +2. C. +6. D. -6.
Phát biểu nào sau đây không đúng?
A. Số oxi hoá của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử đó với giả thiết đó là hợp chất ion.
B. Trong hợp chất, oxygen có số oxi hoá bằng -2, trừ một số trường hợp ngoại lệ.
C. Số oxi hoá của hydrogen trong các hydride kim loại bằng +1.
D. Các nguyên tố phi kim có số oxi hoá thay đổi tuỳ thuộc vào hợp chất chứa chúng.







Danh sách bình luận