Độ âm điện của nitrogen gần bằng độ âm điện của chlorine nhưng ở điều kiện thường N2 hoạt động kém Cl2. Giải thích.
Dựa vào cấu tạo của phân tử N2 và Cl2. Phân tử nào có liên kết bền vững hơn thì kém hoạt động hơn
- Cấu tạo của phân tử N2: N≡N
- Cấu tạo của phân tử Cl2: Cl-Cl
-> Ở điều kiện thường, phân tử nitrogen có liên kết ba bền vững nên để tham gia vào phản ứng hóa học cần cung cấp nhiều năng lượng để phá vỡ liên kết ba đó. Còn phân tử chlorine chỉ có liên kết đơn nên dễ phá vỡ hơn
-> Ở điều kiện thường, phân tử nitrogen hoạt động kém hơn phân tử chlorine

Các bài tập cùng chuyên đề
Năng lượng liên kết là gì? Năng lượng liên kết của phân tử Cl2 là 243 kJ/mol cho biết điều gì?
Dựa vào giá trị năng lượng liên kết ở bảng 12.2, hãy chọ phương án đúng khi so sánh độ bền liên kết giữa Cl2, Br2 và I2.
A. I2 > Br2 > Cl2.
B. Br2 > Cl2 > I2.
C. Cl2 > Br2 > I2.
D. Cl2 > I2 > Br2.
Sắp xếp năng lượng của các loại liên kết: liên kết đơn, liên kết đôi, liên kết ba của cùng một cặp nguyên tố theo chiều tăng dần. Giải thích?
Sử dụng bảng giá trị năng lượng liên kết ở Phụ lục 2.
a) Hãy tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
b) Nhiệt độ để bắt đầu phá vỡ liên kết (nhiệt độ phân hủy) trong hai chất trên ứng với một trong hai nhiệt độ sau: 400oC hoặc 1000oC. Em hãy dự đoán nhiệt độ phân hủy của chất nào cao hơn. Vì sao?
Khi phản ứng với H2, các phân tử như F2, N2 cần phải cắt đứt liên kết giữa các nguyên tử. Dựa vào năng lượng liên kết, em hãy dự đoán phản ứng của F2 hay của N2 với H2 sẽ thuận lợi hơn (dễ xảy ra hơn)?
Căn cứ giá trị năng lượng liên kết H-H và N N đã cho, liên kết trong phân tử nào dễ bị phá vỡ hơn?
Theo em vì sao năng lượng liên kết luôn có giá trị dương?
Trình bày các bước trong quá trình lắp ráp mô hình phân tử NH3
Mô hình sau biểu diễn phân tử CH4 hay phân tử CH3Cl?

Các phân tử như F2, N2 khi phản ứng với H2 thì cần cắt đứt liên kết giữa các nguyên tử. Dựa vào năng lượng liên kết, dự đoán phản ứng của F2 hay của N2 với H2 sẽ thuận lợi hơn (dễ xảy ra hơn). Bỏ qua ảnh hưởng của độ bền phân tử sản phẩm tới mức độ phản ứng.
Sử dụng bảng năng lượng của một số liên kết ở điều kiện chuẩn (Phụ lục 2, SGK Hóa học 10, Cánh Diều):
a) Tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
b) Nhiệt độ bắt đầu phân hủy thành nguyên tử hai chất trên là 400oC và 1000oC. Theo em, nhiệt độ phân hủy của chất nào cao hơn? Vì sao?
Cho biết năng lượng liên kết H-H là 436 kJ mol-1. Hãy tính năng lượng cần thiết (theo eV) để phá vỡ liên kết trong một phân tử H2, cho biết 1 eV = 1,602×10-19 J.
Cho biết năng lượng liên kết H - I và H - Br lần lượt là 297 kJ mol-1 và 364 kJ mol-1. Những phát biểu nào sau đây là không đúng?
A. Khi đun nóng, HI bị phân hủy (thành H2 và I2) ở nhiệt độ thấp hơn so với HBr (thành H2 và Br2).
B. Liên kết H - Br là bền vững hơn so với liên kết H - I.
C. Khi đun nóng, HI bị phân hủy (thành H2 và I2) ở nhiệt độ cao hơn so với HBr (thành H2 và Br2).
D. Liên kết H - I là bền vững hơn so với liên kết H - Br.
Dưới đây là biểu đồ tương tác của hai nguyên tử hydrogen ở thể khí so với khoảng cách hạt nhân giữa chúng:
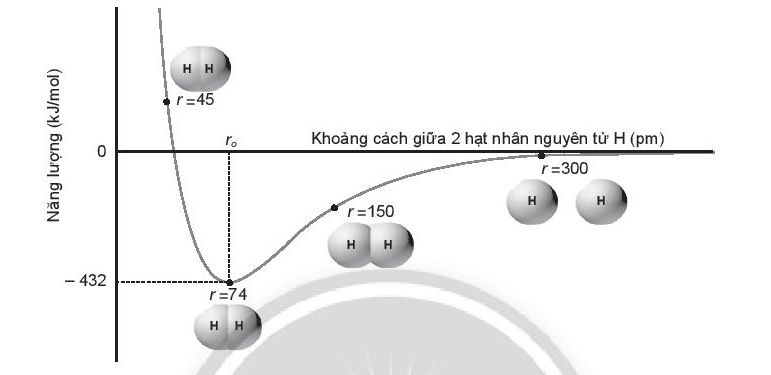
Cho biết năng lượng liên kết của phân tử hydrogen (H2) và độ dài liên kết H-H là bao nhiêu? Giải thích.
Giải thích vì sao độ âm điện của nitrogen là 3,04 xấp xỉ với độ âm điện của chlorine là 3,16 nhưng ở điều kiện thường, nitrogen kém hoạt động hơn nhiều so với chlorine.
Nhận xét mối tương quan giữa độ dài liên kết và năng lượng liên kết dựa theo kết quả bảng sau
|
C-C |
C=C |
C≡C |
|
|
Độ dài liên kết (\(\mathop A\limits^o \)) |
1,54 |
1,34 |
1,20 |
|
Năng lượng liên kết (kJ/mol) |
347 |
614 |
839 |
Năng lượng liên kết và độ dài liên kết của C-C, C=C và C≡C trong các phân tử C2H6, C2H4 và C2H2 được cho bởi bảng sau:
|
Liên kết |
C-C trong C2H6 |
C=C trong C2H4 |
C≡C trong C2H2 |
|
Năng lượng liên kết (kJ/mol) |
347 |
614 |
839 |
|
Độ dài liên kết (nm) |
0,154 |
0,134 |
0,121 |
a) Nêu mối quan hệ giữa chiều dài liên kết và năng lượng liên kết giữa các nguyên tử carbon trong các hydrocarbon đã cho.
b) Giải thích vì sao giá trị năng lượng liên kết tăng theo thứ tự C-C, C=C, C≡C.
Phát biểu nào sau đây đúng với độ bền của một liên kết?
-
A.
Khi nhiều liên kết được hình thành giữa hai nguyên tử, độ bền của liên kết sẽ giảm.
-
B.
Độ bền của liên kết tăng khi độ dài của liên kết tăng.
-
C.
Độ bền của liên kết tăng khi độ dài của liên kết giảm.
-
D.
Độ bền của liên kết không phụ thuộc vào độ dài liên kết.







Danh sách bình luận