Phân lớp 3d có số electron tối đa là
A. 6.
B. 18.
C. 14.
D. 10.
Dựa vào
- Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau
- Các phân lớp s, p, d, f lần lượt có số AO (Atomic Orbital) tương ứng là 1, 3, 5, 7
- Phân lớp d có 5 AO, mỗi AO chứa tối đa 2 electron => Phân lớp d chứa tối đa 2.5 = 10 electron
=> Đáp án: D

Các bài tập cùng chuyên đề
Hãy cho biết tổng số electron tối đa chứa trong
a) Phân lớp p
b) Phân lớp d
Lớp electron có số electron tối đa gọi là lớp electron bão hòa. Tổng số electron tối đa có trong các lớp L và M là
A. 2 và 8
B. 8 và 10
C. 8 và 18
D. 18 và 32
Cho biết sự phân bố electron theo lớp của các nguyên tử H, He, Li như sau:
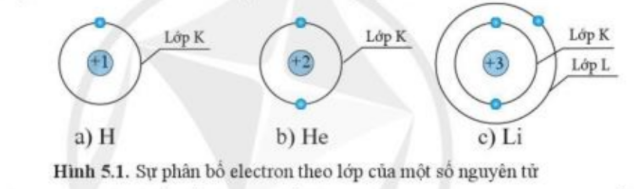
Dựa vào hình 5.1, hãy cho biết số electron tối đa ở lớp K của các nguyên tử có số hiệu nguyên tử Z $ \geqslant $ 2 là bao nhiêu. Theo em, thứ tự phân bố electron vào lớp vỏ nguyên tử như thế nào?
Vì sao số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó?
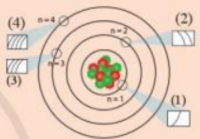
Các ô (1), (2), (3), (4) trong hình dưới đây liên hệ với nội dung nào về cấu tạo lớp vỏ nguyên tử?
Lớp electron thứ tư (n = 4) có bao nhiêu phân lớp và kí hiệu các phân lớp này là gì?
Tính số electron tối đa (bão hòa) trên mỗi phân lớp ns, np, nd, nf.
Quan sát Hình 4.5, nhận xét cách gọi tên các lớp electron bằng các chữ cái tương ứng với các lớp từ 1 đến 7
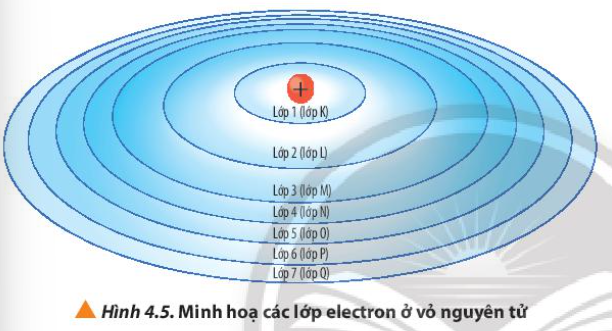
Từ Hình 4.5, cho biết lực hút của hạt nhân với electron ở lớp nào là lớn nhất và lớp nào là nhỏ nhất
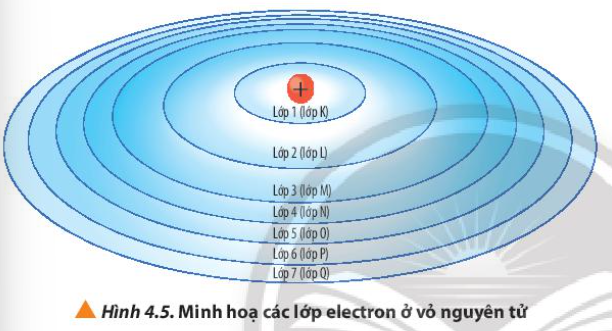
Quan sát Hình 4.6, nhận xét về số lượng phân lớp trong các các lớp từ 1 đến 4
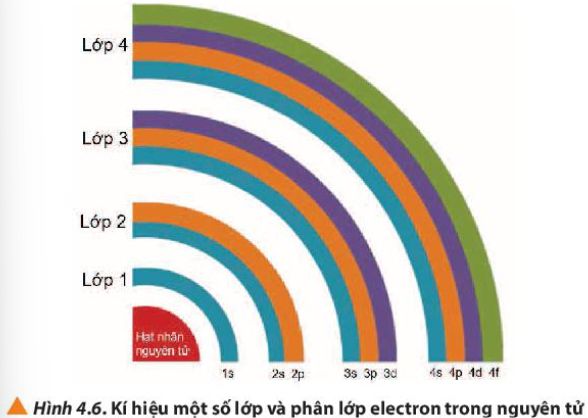
Quan sát Hình 4.7, nhận xét chiều tăng năng lượng của các electron trên các AO ở trạng thái cơ bản (trạng thái có năng lượng thấp nhất)
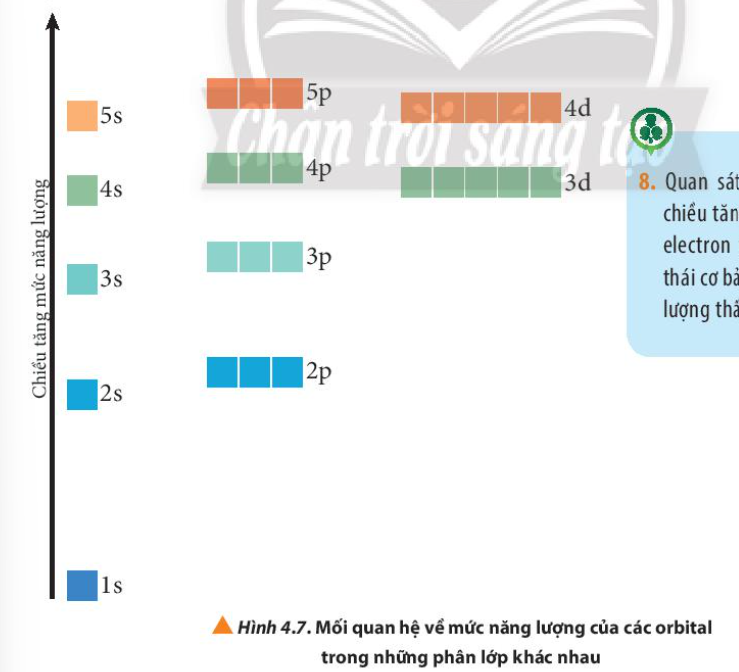
Quan sát Hình 4.9, hãy cho biết nguyên tử oxygen có bao nhiêu electron ghép đôi và bao nhiêu electron độc thân
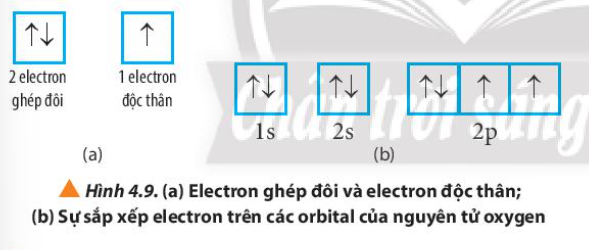
Từ Bảng 4.1, hãy chỉ ra mối quan hệ giữa số thứ tự lớp và số electron tối đa trong mỗi lớp
Quan sát Hình 4.10, hãy nhận xét số lượng electron độc thân ở mỗi trường hợp

Trong các trường hợp (a) và (b) dưới đây, trường hợp nào có sự phân bố electron vào các orbital tuân theo và không tuân theo quy tắc Hund
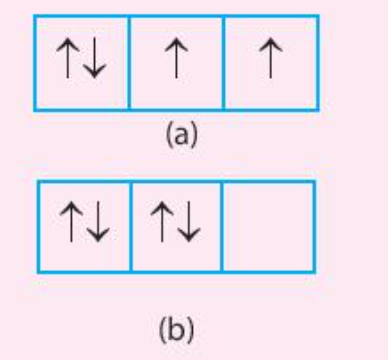
Trong các cách biểu diễn electron và các orbital của phân lớp 2p ở trạng thái cơ bản, hãy chọn cách phân bố đúng:

Ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây có electron độc thân?
a) Boron
b) Oxygen
c) Phosphorus
d) Chlorine
Cho biết tổng số electron tối đa chứa trong:
a) Phân lớp p;
b) Phân lớp d;
c) Lớp K;
d) Lớp M.
Nêu mối quan hệ về năng lượng của electron trên các orbital, các phân lớp, các lớp electron.
Trường hợp trong orbital p có chứa hai electron thì có những cách nào biểu diễn electron trong orbital đó? Cách nào tuân theo quy tắc Hund?
Dùng ô orbital để mô tả cách sắp xếp electron trong orbital s.

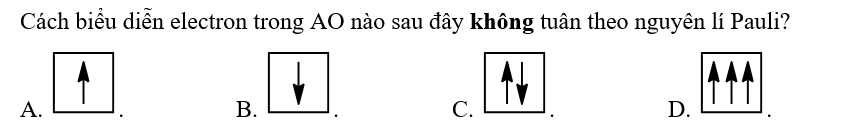
Nguyên tố X có Z = 17. Electron lớp ngoài cùng của nguyên tử nguyên tố X thuộc lớp
A. K.
B. L.
C. M.
D. N.
Các electron của nguyên tử nguyên tố X được phân bố trên ba lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
A. 6.
B. 8.
C. 14.
D. 16.
Lớp M có số electron tối đa bằng
A. 3.
B. 4.
C. 9.
D. 18.
Lớp M có số orbital tối đa bằng
A. 3.
B. 4.
C. 9.
D. 18.
Lớp L có số phân lớp electron bằng
A. 1.
B. 2.
C. 3.
D. 4.







Danh sách bình luận