Số oxi hoá thấp nhất và cao nhất của nguyên tử nitrogen lần lượt là
A. 0 và +5. B. −3 và 0. C. -3 và +5. D. −2 và +4.
Số oxi hóa của N: -3; 0; +1; +2; +3; +4; +5.
Số oxi hoá thấp nhất và cao nhất của nguyên tử nitrogen lần lượt là -3 và +5.
→ Chọn C.

Các bài tập cùng chuyên đề
2. Trong phương trình hoá học của phản ứng tổng hợp ammonia, hãy xác định các nguyên tử có sự thay đổi số oxi hoá và vai trò của nitrogen.
3. Trong phương trình hoá học của phản ứng giữa nitrogen với oxygen:
a) Hãy xác định các nguyên tử có sự thay đổi số oxi hoá.
b) Tại sao thực tế không sử dụng phản ứng này để tạo ra NO, một hợp chất trung gian quan trọng trong công nghiệp sản xuất nitric acid?
4. Viết các phương trình hoá học minh hoạ quá trình hình thành đạm nitrate trong tự nhiên xuất phát từ nitrogen.
Quan sát Hình 3.2, nêu hiện tượng xảy ra. Giải thích.
Dựa vào giá trị biến thiên enthalpy chuẩn của phản ứng, hay cho biết phản ứng giữa nitrogen với hydrogen hay với oxygen diễn ra thuận lợi hơn.
Sử dụng kiến thức hoá học để giải thích câu ca dao sau:
“Lúa chiêm lấp ló đầu bờ
Hễ nghe tiếng sấm, phất cờ mà lên”
Dựa vào các giá trị năng lượng liên kết, hãy dự đoán ở nhiệt độ thường thì đơn chất nitrogen hay chlorine dễ phản ứng với hydrogen hơn. Cho biết năng lượng liên kết Cl − Cl trong phân tử chlorine là 243 kJ.mol-1.
Viết phương trình hoá học của phản ứng giữa nitrogen với hydrogen và với oxygen. Nếu ứng dụng của mỗi phản ứng này trong thực tế.
Trong công nghiệp, ammonia được sản xuất dựa vào phản ứng thuận nghịch giữa nitrogen và hydrogen trong thiết bị kín.
a) Khi phản ứng đạt trạng thái cân bằng thì trong thiết bị sẽ có các khí nào?
b) Hãy tìm hiểu về nhiệt độ hoá lỏng của mỗi khi có trong thiết bị. Từ đó cho biết, nếu giữ nguyên áp suất và làm lạnh thiết bị thì khí nào sẽ hoá lỏng đầu tiên.
Biến thiên enthalpy chuẩn của phản ứng tổng hợp ammonia từ nitrogen và hydrogen có giá trị âm nhưng vì sao quá trình Haber lại chọn nhiệt độ phản ứng khá cao, vào khoảng 400 °C – 600 °C?
Viết phương trình hoá học chứng minh tính oxi hoá và tính khử của nitrogen. Cho biết số oxi hoá của nitrogen thay đổi như thế nào trong các phản ứng hoá học đó.
Dựa vào giá trị năng lượng liên kết (Eb), hãy dự đoán ở điều kiện thường, chất nào (nitrogen, hydrogen, oxygen, chlorine) khó và dễ tham gia phản ứng hoá học nhất. Vì sao?
\[\begin{array}{l}{\rm{a) }}{{\rm{N}}_{\rm{2}}}{\rm{ (g) }} \to {\rm{ 2N (g) }}{{\rm{E}}_{\rm{b}}}{\rm{ = 945 kJ/mol}}\\{\rm{b) }}{{\rm{H}}_{\rm{2}}}{\rm{ (g) }} \to {\rm{ 2H (g) }}{{\rm{E}}_{\rm{b}}}{\rm{ = 432 kJ/mol}}\\{\rm{c) }}{{\rm{O}}_{\rm{2}}}{\rm{ (g) }} \to {\rm{ 2O (g) }}{{\rm{E}}_{\rm{b}}}{\rm{ = 498 kJ/mol}}\\{\rm{d) C}}{{\rm{l}}_{\rm{2}}}{\rm{ (g) }} \to {\rm{ 2Cl (g) }}{{\rm{E}}_{\rm{b}}}{\rm{ = 243 kJ/mol}}\end{array}\]
Nitrogen nặng hơn hay nhẹ hơn không khí. Tại sao?
Xác định tính oxi hoá, tính khử của nitrogen trong phản ứng của N2 với H2 và với O2. Cho biết các phản ứng này thu nhiệt hay toả nhiệt.
1. Viết công thức electron, công thức Lewis và công thức cấu tạo của phân tử nitrogen.
2. Từ cấu tạo phân tử, hãy cho biết tại sao phân tử N2 có năng lượng liên kết lớn. Dự đoán về khả năng hoạt động hóa học của nitrogen ở nhiệt độ thường.
a) Tại sao nitrogen lỏng được dùng để bảo quản mẫu vật phẩm trong y học?
b) Tại sao dùng khí nitrogen để làm căng vỏ bao bì thực phẩm mà không dùng không khí?
Thêm nước vào 10 mL dung dịch HCI 1,0 mol/l đề được 1 000 mL dung dịch A. Dung dịch mới thu được có pH thay đổi như thế nào so với dung dịch ban đầu?
A. pH giảm đi 2 đơn vị. B. Độ pH giảm đi 0,5 đơn vị.
C. pH tăng gấp đôi. D. pH tăng 2 đơn vị.
Cho bảng giá trị năng lượng của một số liên kết ở điều kiện chuẩn sau:
|
Liên kết |
H─H |
N─H |
NN |
|
Năng lượng liên kết (kJ mol−1) |
436 |
389 |
946 |
a) Tính giá trị biến thiên enthalpy chuẩn của phản ứng sau theo năng lượng liên kết:
N2(g) + 3H2(g) ⇌ 2NH3(g)
b) Từ kết quả tính ở a) thì có thể suy ra giá trị enthalpy tạo thành chuẩn của khí ammonia là bao nhiêu kJ mol−1
c) Kết quả thực nghiệm xác nhận giá trị enthalpy tạo thành chuẩn của khí ammonia là -45,9 kJ mol−1. Hãy cho biết vì sao có sự khác biệt về giá trị enthalpy tạo thành chuẩn của khí ammonia theo kết quả tính ở b) và kết quả thực nghiệm.
Cho hai phương trình hoá học sau:
N2(g) + O2(g) → 2NO(g) ΔrHo298 = 180kJ (1)
2NO(g) + O2(g) → 2NO2(g) ΔrHo298 = -114kJ (2)
Những phát biểu nào sau đây về hai phương trình hoá học trên là đúng?
(a) Phản ứng (1) là phản ứng thu nhiệt, phản ứng (2) là phản ứng toả nhiệt.
(b) Phản ứng (2) tạo NO2 từ NO, là quá trình thuận lợi về mặt năng lượng.
Điều này cũng phù hợp với thực tế là khí NO (không màu) nhanh chóng bị oxi hoá thành khí NO2 (màu nâu đỏ).
(c) Enthalpy tạo thành chuẩn của NO2 là 80 kJ mol−1.
(d) Từ giá trị biến thiên enthalpy chuẩn của phản ứng (1) và năng lượng liên kết trong phân tử O2, N2 lần lượt là 498 kJ mol−1 và 946 kJ mol, tính được năng lượng liên kết trong phân tử NO ở cùng điều kiện là 632 kJ mol−1.
Sau mỗi chu trình tổng hợp ammonia đều thực hiện tách ammonia khỏi hỗn hợp khí gồm: nitrogen, hydrogen và ammonia. Sau đó, nitrogen và hydrogen lại được dẫn về thực hiện vòng tuần hoàn mới.
Cho biết nhiệt độ sôi nitrogen, hydrogen và ammonia lần lượt là –196 °C, −253 °C và −33 °C.
Đề xuất phương pháp vật lí tách ammonia khỏi hỗn hợp đó.
Cho cân bằng ở 1 650 °C: \({{\rm{N}}_{\rm{2}}}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ }}2{\rm{NO}}\left( g \right){\rm{ }}{{\rm{K}}_{\rm{C}}} = {4.10^{ - 4}}\)
Thực hiện phản ứng trên với một hỗn hợp nitrogen và oxygen có tỉ lệ mol tương ứng là 4 : 1. Tính hiệu suất của phản ứng khi hệ cân bằng ở 1 650 °C.
Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 3. Nung nóng X trong bình kín (450 oC, xúc tác Fe) một thời gian, thu được hỗn hợp khí có số mol giảm 5% so với ban đầu. Tính hiệu suất của phản ứng tổng hợp NH3.
Trong công nghiệp, ammonia được sản xuất theo phản ứng pha khí:
\({{\rm{N}}_{\rm{2}}}(g) + 3{{\rm{H}}_2}(g) \to 2{\rm{N}}{{\rm{H}}_3}(g){\rm{ }}{\Delta _r}{\rm{H}}^\circ \)
Cho biết các giá trị năng lượng liên kết Eb (kJ.mol-1):
|
Liên kết |
N≡N |
H-H |
N-H |
|
Eb |
945 |
436 |
386 |
a) Tính nhiệt phản ứng ∆rH° của phản ứng ở điều kiện chuẩn, nhận xét về dấu và độ lớn của giá trị tìm được.
b) Tính nhiệt tạo thành ∆fH° (kJ.mol-1) của NH3 (g).
Cho sơ đồ chuyển hoá nitrogen trong khí quyển thành phân đạm:
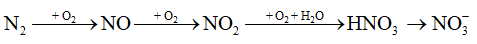
Số phản ứng thuộc loại oxi hoá-khử trong sơ đồ là
A. 3. B. 1. C. 4. D. 2.
Trong nghiên cứu, khí nitrogen thường được dùng để tạo bầu khí quyển trơ dựa trên cơ sở nào?
A. Nitrogen có tính oxi hoá mạnh. B. Nitrogen rất bền với nhiệt.
C. Nitrogen khó hoá lỏng. D. Nitrogen không có cực.
Nhận định nào sau đây về đơn chất nitrogen là sai?
A. Không màu và nhẹ hơn không khí.
B. Hoả hợp với oxygen ở nhiệt độ cao hoặc tia lửa điện.
C. Thể hiện tính oxi hoá mạnh ở điều kiện thường.
D. Khó hoá lỏng và ít tan trong nước.
Nhận định nào sau đây về phân tử nitrogen là đúng?
A. Có ba liên kết đơn bền vững.
B. Chứa nguyên tử nitrogen có số oxi hoá là -3.
C. Có liên kết cộng hoá trị có cực.
D. Thể hiện cả tính oxi hoá và tính khử.
Nitrogen thể hiện tính khử trong phản ứng nào sau đây?
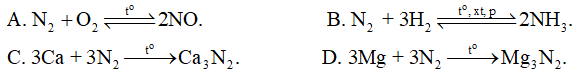
Trong tự nhiên, nguyên tố nitrogen có hai đồng vị bền là 14N (99,63%) và 15N (0,37%). Nguyên tử khối trung bình của nitrogen là
A. 14,000. B. 14,004. C. 14,037. D. 14,063.
Trong phản ứng hoá hợp với oxygen, nitrogen đóng vai trò là
A. chất oxi hoá. B. base. C. chất khử. D. acid
Trong những cơn mưa dông kèm sấm sét, nitrogen kết hợp trực tiếp với oxygen tạo thành sản phẩm là
A. NO. B. N2O. C. NH3. D. NO2.
Trong phản ứng tổng hợp ammonia từ nitrogen và hydrogen, nitrogen đóng vai trò là
A. chất khử. B. chất oxi hoá. C. acid. D. base.







Danh sách bình luận