Cho phản ứng:
2N2O5(g) → 4NO2(g) + O2(g)
Sau thời gian từ giây 61 đến giây 120, nồng độ NO2 tăng từ 0,30M lên 0,40M. Tính tốc độ trung bình của phản ứng
Áp dụng công thức: \(\mathop v\limits^\_ = - \frac{1}{a}\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}\frac{{\Delta {C_D}}}{{\Delta t}}\)
Vì NO2 là chất sản phẩm
=> \(\mathop v\limits^\_ = \frac{1}{4}\frac{{\Delta {C_{N{O_2}}}}}{{\Delta t}} = \frac{1}{4}\frac{{0,4 - 0,3}}{{120 - 61}} = 4,{2.10^{ - 4}}(M/s)\)

Các bài tập cùng chuyên đề
Cho phản ứng của các chất ở thể khí: X + Y → XY
Biết tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia và phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hóa học.
a) Hãy viết phương trình tốc độ của phản ứng này.
b) Ở một nhiệt độ xác định, hằng số tốc độ của phản ứng này là 2,5.10-4L/(mol.s).
Nồng độ đầu của X và Y lần lượt là 0,02 M và 0,03 M. Hãy tính tốc độ phản ứng:
- Tại thời điểm đầu.
- Tại thời điểm đã hết một nửa lượng X.
Nêu mối liên hệ giữa nồng độ và áp suất của khí trong hỗn hợp.
Em có nhận xét gì nếu trong biểu thức (5), nồng độ của chất A và B đều bằng 1M?
v = k\(C_A^aC_B^b\) (5)
Trong phản ứng (6), nếu nồng độ của H2tăng gấp đôi thì tốc độ phản ứng thay đổi như thế nào?
H2(g) + I2(g) → 2HI(g)
Khi nồng độ của H2(g) cũng như I2(g) đều tăng lên gấp đôi thì tốc độ phản ứng của H2(g) với I2(g) tăng lên mấy lần?
Theo định luật tác dụng khối lượng, tốc độ phản ứng thay đổi như thế nào khi tăng hoặc giảm nồng độ chất phản ứng
Cho phản ứng đơn giản sau:
H2(g) + Cl2(g) → 2HCl(g)
a) Viết biểu thức tốc độ tức thời của phản ứng trên
b) Tốc độ phản ứng thay đổi thế nào khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2?
Dưới đây là một số hiện tượng xảy ra trong đời sống, hãy sắp xếp theo thứ tự tốc độ giảm dần:
|
Nướng bánh mì |
(1) |
|
Đốt gas khi nấu ăn |
(2) |
|
Lên men sữa tạo ra sữa chua |
(3) |
|
Tấm tôn thiếc bị gỉ sét |
(4) |
Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O2(g) → 2NO2(g)
a) Viết biểu thức tốc độ tức thời của phản ứng
b) Ở nhiệt độ không đổi, tốc độ phản ứng thay đổi thế nào khi
- nồng độ O2 tăng 3 lần, nồng độ NO không đổi?
- nồng độ NO tăng 3 lần, nồng độ O2 không đổi?
- nồng độ NO và O2 đều tăng 3 lần?
Giải thích tại sao tốc độ tiêu hao của NO (M/s) và tốc độ tạo thành của N2 (M/s) không giống nhau trong phản ứng:
2CO(g) + 2NO(g) → 2CO2(g) + N2(g)
Dữ liệu thí nghiệm của phản ứng: SO2Cl2(g) → SO2(g) + Cl2(g) được trình bày ở bảng sau: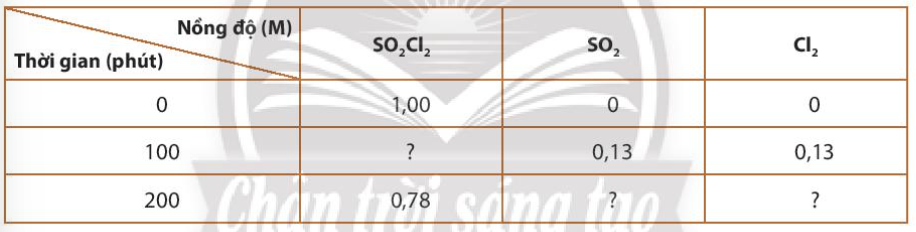
a) Tính tốc độ trung bình của phản ứng theo SO2Cl2 trong thời gian 100 phút.
b) Sau 100 phút, nồng độ của SO2Cl2 còn lại là bao nhiêu
c) Sau 200 phút, nồng độ của SO2 và Cl2 thu được là bao nhiêu?
Những phát biểu nào sau đây không đúng?
A. Phản ứng đơn giản là phản ứng xảy ra theo một bước.
B. Phản ứng đơn giản là phản ứng có các hệ số tỉ lượng trong phương trình hóa học bằng nhau và bằng 1.
C. Tốc độ của một phản ứng đơn giản tuân theo định luật tác dụng khối lượng.
D. Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng.
E. Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
G. Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
H. Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
Khi cho một lượng xác định chất phản ứng vào bình để cho phản ứng hoá học xảy ra, tốc độ phản ứng sẽ
A. không đổi cho đến khi kết thúc.
B. tăng dần cho đến khi kết thúc.
C. chậm dần cho đến khi kết thúc.
D. tuân theo định luật tác dụng khối lượng.
Đề bài: Xét phản ứng sau:
2ClO2 + 2NaOH → NaClO3 + NaClO2 + H2O
Tốc độ phản ứng được viết như sau: \(v = k.C_{Cl{O_2}}^x.C_{NaOH}^y\)
Thực hiện phản ứng với những nồng độ chất đầu khác nhau và đo tốc độ phản ứng tương ứng thu được kết quả trong bảng sau:
|
STT |
Nồng độ ClO2 (M) |
Nồng độ NaOH (M) |
Tốc độ phản ứng (mol/(L.s)) |
|
1 |
0,01 |
0,01 |
2.10-4 |
|
2 |
0,02 |
0,01 |
8.10-4 |
|
3 |
0,01 |
0,02 |
4.10-4 |
Hãy tính x và y trong biểu thức tốc độ phản ứng.
Cho phân ứng hóa học sau:
H2O2 → H2O + O2
Biết rằng tốc độ của phản ứng này tuân theo biểu thức của định luật tác dụng khối lượng.
a) Hãy viết biểu thực tốc độ phản ứng.
b) Tốc độ phản ứng tức thời tăng dần hay giảm dần theo thời gian.
Cho phản ứng hoá học xảy ra trong pha khí sau:
N2 + 3H2 → 2NH3
Phát biểu nào sau đây không đúng? Khi nhiệt độ phản ứng tăng lên,
A. tốc độ chuyển động của phân tử chất đầu (N2, H2) tăng lên.
B. tốc độ va chạm giữa phân tử N2 và H2 tăng lên.
C. số va chạm hiệu quả tăng lên.
D. tốc độ chuyển động của phân tử chất sản phẩm (NH3) giảm.
Xét phản ứng hoá học đơn giản giữa hai chất A và B theo phương trình: A + B → C. Từ thông tin đã cho, hoàn thành bảng dưới đây:
|
Thực nghiệm |
Nồng độ chất A (M) |
Nồng độ chất B (M) |
Tốc độ phản ứng (M/s) |
|
1 |
0,20 |
0,050 |
0,24 |
|
2 |
? |
0,030 |
0,20 |
|
3 |
0,40 |
? |
0,80 |
Từ dữ kiện trong Ví dụ 1 (SGK trang 95), tính tốc độ trung bình của phản ứng theo giá trị nồng độ của MgCl2 trong 40 giây (bỏ qua sự thay đổi không đáng kể về thể tích dung dịch sau phản ứng). So sánh giá trị tốc độ phản ứng tính theo HCl với tính theo MgCl2.
Cho phương trình hoá học của phản ứng:
CO(g) + H2O(g) → CO2(g) + H2(g)
Viết biểu thức tốc độ của phản ứng trên. Khi nồng độ CO tăng 2 lần, lượng hơi nước không thay đổi, tốc độ phản ứng thay đổi như thế nào?
Phương trình hoá học của phản ứng: CHCl3(g) + Cl2(g) → CCl4(g) + HCl(g). Khi nồng độ của CHCl3 giảm 4 lần, nồng độ Cl2 giữ nguyên thì tốc độ phản ứng sẽ
A. tăng gấp đôi
B. giảm một nửa.
C. tăng 4 lần.
D. giảm 4 lần.
Cho phương trình hoá học của phản ứng: 2CO(g) + O2(g) → 2CO2(g). Với biểu thức tốc độ tức thời là \(v = k.C_{CO}^2.{C_{{O_2}}}\), khi nồng độ mol của CO là 1 M và O2 là 1 M, tính giá trị v và nêu ý nghĩa của k.
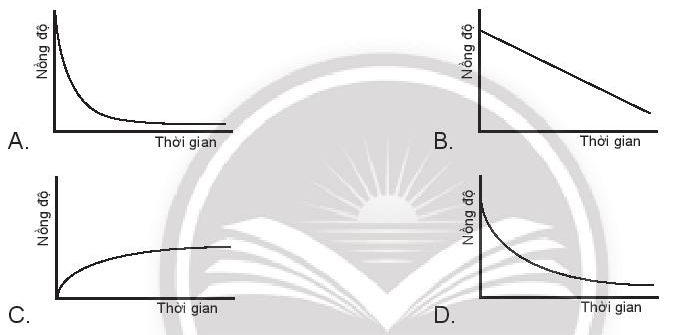
Nếu mỗi đồ thị có các chất phản ứng cùng nồng độ và trục thời gian thì tốc độ của chất phản ứng nào xảy ra nhanh nhất?
Phản ứng 2NO(g) + O2(g) → 2NO2(g) có biểu thức tốc độ tức thời: v= \(k.C_{NO}^2.{C_{{O_2}}}\). Nếu nồng độ của NO giảm 2 lần, giữ nguyên nồng độ oxygen, thì tốc độ sẽ
A. giảm 2 lần.
B. giảm 4 lần.
C. giảm 3 lần.
D. giữ nguyên.
Cho phản ứng: 2CO(g) + O2(g) ⟶ 2CO2(g).
Tốc độ phản ứng thay đổi như thế nào nếu tăng nồng độ CO gấp 3 lần, các chất khác giữ nguyên nồng độ?
-
A.
Tăng gấp 3 lần.
-
B.
Tăng gấp 6 lần.
-
C.
Tăng gấp 9 lần.
-
D.
Giảm 3 lần.
Cho phản ứng: Br2(l) + HCOOH(aq)→2HBr(aq) + CO2(s).
Nồng độ ban đầu của Br2 là aM, sau 50 giây nồng độ Br2 còn lại là 0,02M. Tốc độ trung bình của phản ứng trên là 4.10-5M/s. Giá trị của a là
-
A.
0,02 M.
-
B.
0,07 M.
-
C.
0,02 M.
-
D.
0,022 M.
Cho phản ứng đơn giản xảy ra trong bình kín: H2(g) + Cl2 (g) ⟶ 2HCl (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 giảm 4 lần và nồng độ Cl2 tăng 2 lần.
-
A.
tăng 4 lần.
-
B.
giảm 4 lần.
-
C.
giảm 2 lần.
-
D.
tăng 8 lần.
Cho phản ứng đơn giản sau:
CHCl3(g) + Cl2(g) → CCl4(g) + HCl(g)
Biểu thức tốc độ tức thời của phản ứng viết theo định luật tác dụng khối lượng là
-
A.
v = \(k \times {C_{CHC{l_3}}} \times {C_{C{l_2}}}.\)
-
B.
v = \(k \times {C_{CC{l_4}}} \times {C_{HCl}}.\)
-
C.
v = \({C_{CHC{l_3}}} \times {C_{C{l_2}}}.\)
-
D.
v = \({C_{CC{l_4}}} \times {C_{HCl}}.\)
-
A.
Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp.
-
B.
Tốc độ phản ứng có thể nhận giá trị dương hoặc âm.
-
C.
Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó.
-
D.
Tốc độ phản ứng đốt cháy cồn (alcohol) lớn hơn tốc độ của phản ứng gỉ sắt.
-
A.
Tốc độ tiêu hao chất B bằng 3/2 tốc độ tạo thành chất C.
-
B.
Tốc độ tiêu hao chất B bằng 2/3 tốc độ tạo thành chất C.
-
C.
Tốc độ tiêu hao chất B bằng 3 tốc độ tạo thành chất C.
-
D.
Tốc độ tiêu hao chất B bằng 1/3 tốc độ tạo thành chất C.
-
A.
\(v = - \frac{{\Delta {C_{{H_2}}}}}{{\Delta t}}\).
-
B.
\(\overline v = - \frac{{\Delta {C_{{I_2}}}}}{{\Delta t}}\).
-
C.
\(v = k{C_{{H_2}}}{C_{{I_2}}}.\)
-
D.
\(v = \frac{{\Delta {C_{HI}}}}{{\Delta t}}\) .







Danh sách bình luận