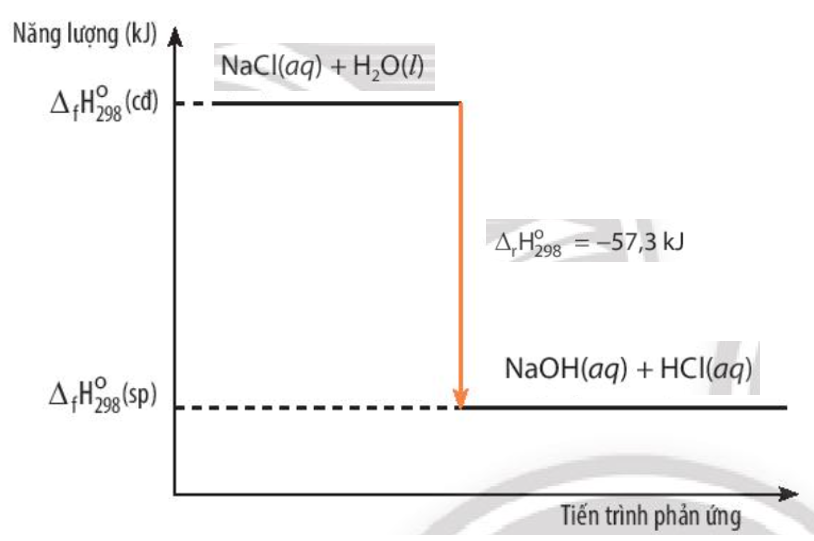
Cho phương trình nhiệt hóa học sau:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) \({\Delta _r}H_{298}^o\)= -57,3 kJ
Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng
\({\Delta _r}H_{298}^o\)= \({\Delta _f}H_{298}^o\)(sp) - \({\Delta _f}H_{298}^o\)(cđ)
Ta có: \({\Delta _r}H_{298}^o\)= \({\Delta _f}H_{298}^o\)(sp) - \({\Delta _f}H_{298}^o\)(cđ) = -57,3 kJ

Các bài tập cùng chuyên đề
Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng tỏa ra là bao nhiêu?
Cho biết biến thiên enthalpy của phản ứng sau ở điều kiện tiêu chuẩn:
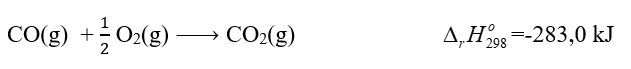
Biết nhiệt tạo thành chuẩn của CO2: \({\Delta _r}H_{298}^o\) (CO2(g)) = - 393,5 kJ/mol
Nhiệt tạo thành chuẩn của CO là:
A. -110,5 kJ/mol
B. +110,5 kJ/mol
C. -141,5 kJ/mol
D. -221,0 kJ/mol
Dung dịch glucose (C6H12O6) 5% có khối lượng riêng là 1,02 g/mL, phản ứng oxi hóa 1 mol glucose tạo thành CO2(g) và H2O (l) tỏa ra nhiệt lượng là 2803,0 kJ. Một người bệnh được truyền một chai chứa 500 ml dung dịch glucose 5%. Năng lượng tối đa từ phản ứng oxi hóa thành glucose mà bênh nhân đó có thể nhận được là:
A. +397,09 kJ.
B.+381,67 kJ.
C. +389,30 kJ.
D. +416,02 kJ.
So sánh nhiệt tỏa ra khi đốt cháy hoàn toàn 1 kg cồn (C2H5OH) và 1 kg tristearin (C57H110O6), có trong mỡ lợn). Cho biết:
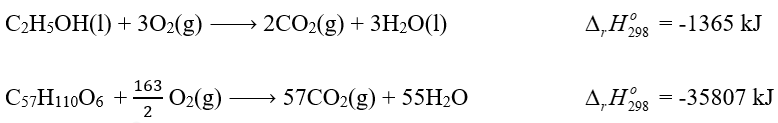
Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) có được coi là nhiệt tạo thành chuẩn của Na2O(s) không? Giả sử Na tác dụng được với O3 thu được Na2O.
Trong ví dụ 1, ở cùng điều kiện phản ứng, nếu chỉ thu được 0,5 mol Na2O thì lượng nhiệt tỏa ra là bao nhiêu kJ?
Vì sao enthalpy tạo thành của một đơn chất bền lại bằng không?
Giá trị ${\Delta _r}H_{298}^0$ của phản ứng sau là bao nhiêu kJ?
½ CH4(g) + O2(g) → ½ CO2(g) + H2O(l)
Đốt cháy hoàn toàn 1 gam C2H2(g) ở điều kiện chuẩn, thu được CO2(g) và H2O(l), giải phóng 49,98 kJ. Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy 1 mol C2H2.
Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam CH4(g) để cung cấp nhiệt cho phản ứng tạo 1 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
Sự hô hấp cung cấp oxygen cho các phản ứng oxi hóa chất béo, chất đường, tinh bột, … trong cơ thể con người. Đó là các phản ứng giải phóng hay hấp thụ năng lượng? Năng lượng kèm theo các phản ứng này dùng để làm gì?
Cho biết phản ứng sau có ${\Delta _t},H_{298}^o$ > 0 và diễn ra ở ngay nhiệt độ phòng.
2NH4NO3(s) + Ba(OH)2.8H2O(s) → 2NH3(aq) + Ba(NO3)2(aq) + 10H2O(l)
Khi trộn đều một lượng ammonium nitrate (NH4NO3) rắn với một lượng barium hydroxide ngậm nước (Ba(OH)2.8H2O) ở nhiệt độ phòng thì nhiệt độ của hỗn hợp sẽ tăng hay giảm? Giải thích.
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn sau đây tỏa ra 184,6 kJ:
H2(g) + Cl2(g) → 2HCl(g) (*)
Những phát biểu sau dưới đây là đúng?
A. Nhiệt tạo thành của HCl là -184,6 kJ.mol-1.
B. Biến thiên enthalpy phản ứng (*) là -184,6 kJ.
C. Nhiệt tạo thành của HCl là -92,3 kJ.mol-1.
D. Biến thiên enthalpy phản ứng (*) là -92,3 kJ.
Biến thiên enthalpy chuẩn của một phản ứng hóa học được xác định trong điều kiện nào?
Phương trình nhiệt hóa học cho biết thông tin gì về phản ứng hóa học
Cho hai phương trình nhiệt hóa học sau:
C(s) + H2O(g) \(\xrightarrow{{{t^o}}}\)CO(g) + H2(g) \({\Delta _r}H_{298}^o\) = +131,25 kJ (1)
CuSO4(aq) + Zn(s) → ZnSO4(aq) + Cu(s) \({\Delta _r}H_{298}^o\) = -231,04 kJ (2)
Trong hai phản ứng trên, phản ứng nào thu nhiệt, phản ứng nào tỏa nhiệt?
Phân biệt enthalpy tạo thành của một chất và biến thiên enthalpy của phản ứng. Lấy ví dụ minh họa
Cho phản ứng sau:
S(s) + O2(g) \(\xrightarrow{{{t^o}}}\) SO2(g) \({\Delta _f}H_{298}^o\)(SO2,g) = -296,80 kJ/mol
Cho biết ý nghĩa của giá trị \({\Delta _f}H_{298}^o\)(SO2,g)

Hợp chất SO2(g) bền hơn hay kém bền hơn về mặt năng lượng so với các đơn chất bền S(s) và O2(g)
Từ Bảng 13.1 hãy liệt kê các phản ứng có enthalpy tạo thành dương (lấy nhiệt từ môi trường)
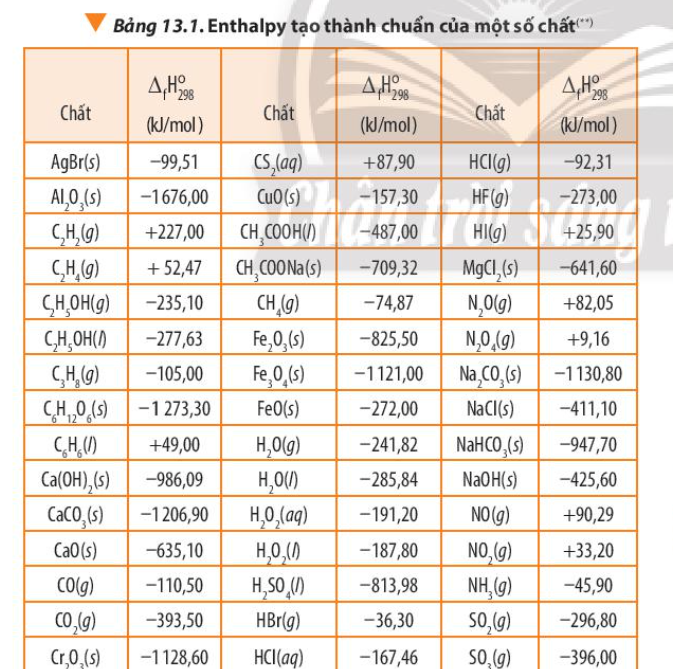
Quan sát Hình 13.5, mô tả sơ đồ biểu diễn biến thiên enthalpy của phản ứng. Nhận xét về giá trị của \({\Delta _f}H_{298}^o\)(sp) so với \({\Delta _f}H_{298}^o\)(cđ)
Vận dụng để vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng nhiệt phân CaCO3 ở Ví dụ 5
Cho hai phương trình nhiệt hóa học sau:
CO(g) + ½ O2(g) → CO2(g) \({\Delta _r}H_{298}^o\) = -283,00 kJ (1)
H2(g) + F2(g) → 2HF(g) \({\Delta _r}H_{298}^o\) = -546,00 kJ (2)
So sánh nhiệt giữa hai phản ứng (1) và (2). Phản ứng nào xảy ra thuận lợi hơn?
Hãy làm cho nhà em sạch bong với hỗn hợp baking soda (NaHCO3) và giấm (CH3COOH). Hỗn hợp này tạo ra một lượng lớn bọt. Phương trình nhiệt hóa học của phản ứng:
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(l) \({\Delta _r}H_{298}^o\)= 94,30 kJ
Phản ứng trên là tỏa nhiệt hay thu nhiệt? Vì sao? Tìm những ứng dụng khác của phản ứng trên

Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) → 2NO(g) \({\Delta _r}H_{298}^o\)= +180 kJ
Kết luận nào sau đây đúng?
A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp
B. Phản ứng tỏa nhiệt
C. Phản ứng xảy ra thuận lợi ở điều kiện thường
D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới. Kết luận nào sau đây là đúng?
A. Phản ứng tỏa nhiệt
B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng chất sản phẩm
C. Biến thiên enthalpy của phản ứng là a kJ/mol
D. Phản ứng thu nhiệt
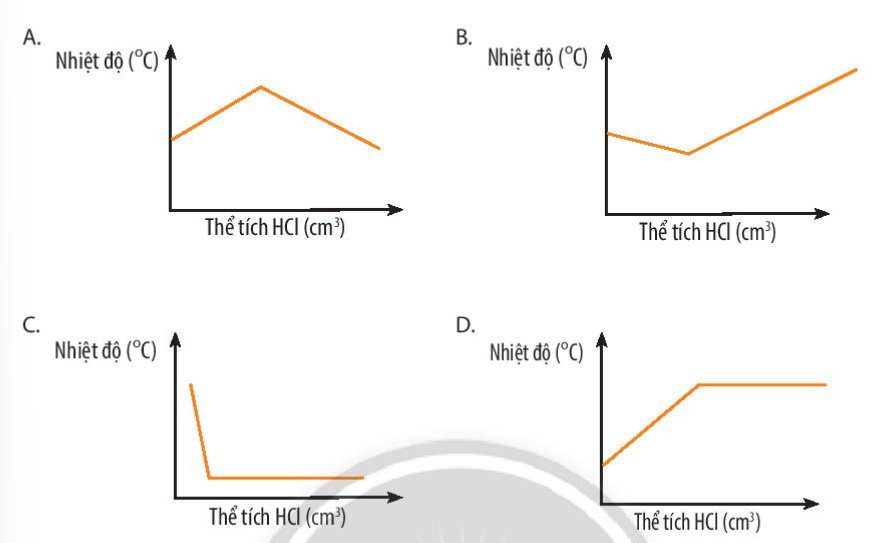
Đồ thị nào sau đây thể hiện đúng sự thay đổi nhiệt độ khi dung dịch hydrochloric acid được cho vào dung dịch sodium hydroxide tới dư?
Ethanol sôi ở 78,29oC. Để làm 1 gam ethanol lỏng nóng thêm 1 oC cần một nhiệt lượng là 1,44J; để 1 gam ethanol hóa hơi (ở 78,29oC) cần một nhiệt lượng là 855 J. Hãy tính nhiệt lượng cần cung cấp để làm nóng 1 kg ethanol từ 20,0 oC đến nhiệt độ sôi và hóa hơi hoàn toàn ở nhiệt độ đó.







Danh sách bình luận