Viết công thức hydroxide của nguyên tố Sr (Z = 38) và dự đoán hydroxide này có tính base mạnh hay yếu.
Một acid của Se (Z = 34) có công thức H2SeO4. Acid này là acid mạnh hay yếu?
1.
- Viết cấu hình electron nguyên tử Sr (Z = 38), xác định vị trí của Sr trong bảng tuần hoàn.
- Từ vị trí và đơn vị điện tích hạt nhân dự đoán hydroxide của Sr tính base mạnh hay yếu.
2.
- Viết cấu hình electron nguyên tử Se (Z = 34), xác định vị trí của Se trong bảng tuần hoàn.
- Từ vị trí và đơn vị điện tích hạt nhân dự đoán H2SeO4 có tính acid mạnh hay yếu.
1.
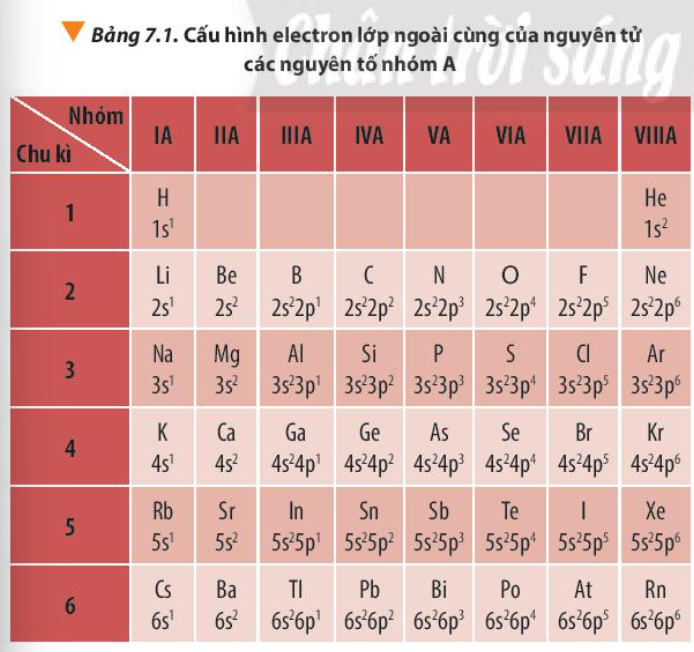
- Sr (Z = 38): 1s22s22p63s23p64s23d104p65s2
Cấu hình e rút gọn: [Kr] 5s2
- Sr ở ô số 38, chu kì 5, thuộc nhóm IIA.
- Hydroxit của Sr là: Sr(OH)2, là một base mạnh.
2.
- Se (Z = 34): 1s22s22p63s23p64s23d104p4
Cấu hình e rút gọn: [Ar] 3d104s24p4
- Se ở ô số 34, chu kì 4, thuộc nhóm VIA
- Acid của Se là: H2SeO4, là một acid yếu.

Các bài tập cùng chuyên đề
Nguyên tố X có Z = 38, có cấu hình electron lớp ngoài cùng và sát ngoài cùng là 4s24p65s2.
a) Cho biết vị trí của X trong bảng tuần hoàn.
b) Hãy cho biết tính chất hóa học cơ bản của X là gì?
c) Viết công thức oxide và hydroxide cao nhất của X.
d) Viết phương trình phản ứng hóa học khi cho X tác dụng với Cl2.
Trình bày các quy luật về xu hướng biến đổi bán kinh, tính kim loại, tính phi kim, độ âm điện của nguyên tử các nguyên tố trong một chu kì và trong một nhóm.
Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần
A. khối lượng nguyên tử
B. bán kính nguyên tử
C. số hiệu nguyên tử
D. độ âm điện của nguyên tử
Dựa trên các kiến thức đã được học, hoàn thành những thông tin còn thiếu trong Bảng 7.2

Hãy nêu xu hướng biến đổi một số tính chất của các nguyên tố, đơn chất và hợp chất của chúng để minh họa nội dung của định luật tuần hoàn
Quan sát Bảng 7.1, hãy nhận xét về số electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A trong cùng một chu kì và trong cùng một nhóm
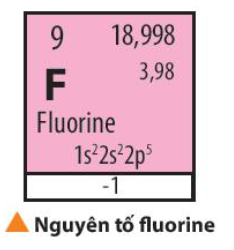
Fluorine được sử dụng làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa. Fluorine (F) là một nguyên tố hóa học có số hiệu nguyên tử bằng 9, thuộc chu kì 2, nhóm VIIA. Từ vị trí của fluorine trong bảng tuần hoàn, có thể dự đoán được tính chất hóa học cơ bản của fluorine không? Khả năng phản ứng của fluorine như thế nào?
Nguyên tố X có số hiệu nguyên tử là 8.
a) Nguyên tử của nguyên tố X có cấu hình electron là
A. 1s22s22p3.
B. 1s22s12p5.
C. 1s12s22p5.
D. 1s22s22p4.
b) Nguyên tố X thuộc chu kì
A. 1.
B. 2.
C. 3.
D. 4.
c) Nguyên tố X thuộc nhóm
A. VIIIB.
B. VIB.
C. VIIA.
D. VIA.
Cấu hình electron nguyên tử iron: (Ar) 3d64s2. Iron ở
A. ô 26, chu kì 4, nhóm VIIIA.
B. ô 26, chu kì 4, nhóm VIIIB.
C. ô 26, chu kì 4, nhóm IIA.
D. ô 26, chu kì 4, nhóm IIB.
Sulfur được sử dụng trong quá trình lưu hoá cao su, làm chất diệt nấm và có trong thuốc nổ đen. Sulfur là nguyên tố nhóm VIA. Công thức oxide cao nhất của sulfur là
A. SO2.
B. SO3.
C. SO6.
D. SO4.
Định luật tuần hoàn phát biểu rằng tính chất của các đơn chất cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố biến đổi tuần hoàn theo chiều tăng của yếu tố nào sau đây?
A. Điện tích hạt nhân nguyên tử.
B. Khối lượng nguyên tử.
C. Bán kính nguyên tử.
D. Số lớp electron.
Chromium được sử dụng nhiều trong luyện kim để chế tạo hợp kim chống ăn mòn và đánh bóng bề mặt. Nguyên tử chromium có cấu hình electron viết gọn là (Ar)3d54s1. Vị trí của chromium trong bảng tuần hoàn là
A. ô số 17, chu kì 4, nhóm IA. B. ô số 24, chu kì 4, nhóm VIB.
C. ô số 24, chu kì 3, nhóm VB. D. ô số 27, chu kì 4, nhóm IB.
Nguyên tố X ở chu kì 3, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s22s22p6.
B. 1s22s22p63s23p1.
C. 1s22s22p63s3.
D. 1s22s22p63s2.
-
A.
sự lặp lại tính kim loại của các nguyên tố ở chu kì sau so với chu kì trước.
-
B.
sự lặp lại tính phi kim của các nguyên tố ở chu kì sau so với chu kì trước.
-
C.
sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trướ
-
D.
sự lặp lại tính chất hóa học của các nguyên tố ở chu kì sau so với chu kì trước.
-
A.
Bán kính nguyên tử.
-
B.
Tính kim loại.
-
C.
Độ âm điện.
-
D.
Khối lượng nguyên tử.
Electron của ion X- là 1s22s22p63s23p63d104s24p6. Cho các phát biểu sau:
(a) X ở ô 36, chu kỳ 4, VIIIA.
(b) Ion X- có 36 proton.
(c) X có tính phi kim.
(d) Bán kính ion X- nhỏ hơn bán kính của X.
Cho các phát biểu sau:
(a) Theo quy luật biến đổi tính chất các đơn chất trong bảng tuần hoàn thì phi kim mạnh nhất là Fluorine
(b) Các nguyên tố nhóm A trong bảng tuần hoàn là là các nguyên tố s và nguyên tố p.
(c) Các nguyên tố nhóm IIA, từ Mg đến Ba, theo chiều điện tích hạt nhân tăng, tính kim loại giảm dần.
(d) Các nguyên tố hoá học trong cùng một nhóm A có cùng số electron lớp ngoài cùng.
(e) Các nguyên tố nhóm VA, Từ N đến Bi, theo chiều điện tích hạt nhân tăng, tính phi kim tăng dần.
(g) Nguyên tố X có cấu hình electron lớp ngoài cùng là 3s23p3. X thuộc nhóm VA.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 9, 17, 35. Phát biểu nào sau đây là sai?
-
A.
Thứ tự độ âm điện: X < Y < Z.
-
B.
Các nguyên tố này đều là phi kim.
-
C.
Thứ tự tăng dần tính kim loại: X < Y < Z.
-
D.
Các nguyên tố này đều thuộc cùng một nhóm.







Danh sách bình luận