Tham khảo Bài 12 (Liên kết cộng hóa trị) hãy:
a) Mô tả sự hình thành liên kết trong phân tử halogen bằng công thức electron
b) Liên kết trong phân tử halogen là liên kết cộng hóa trị phân cực hay không phân cực?
c) Dựa vào bán kính nguyên tử (Hình 6.2), hãy dự đoán xu hướng biến đổi độ dài liên kết trong dãy các phân tử halogen
a) Trong phân tử halogen mỗi nguyên tử halogen sẽ góp 1 electron để tạo thành 1 đôi electron dùng chung
b) Phân tử halogen được hình thành nhờ sự góp chung electron của mỗi nguyên tử halogen
c) Đi từ trên xuống dưới, bán kính nguyên tử tăng dần, độ âm điện giảm dần
=> Độ dài liên kết
a) Khi 2 nguyên tử halogen liên kết với nhau, mỗi nguyên tử sẽ góp 1 electron tạo thành 1 cặp electron dùng chung
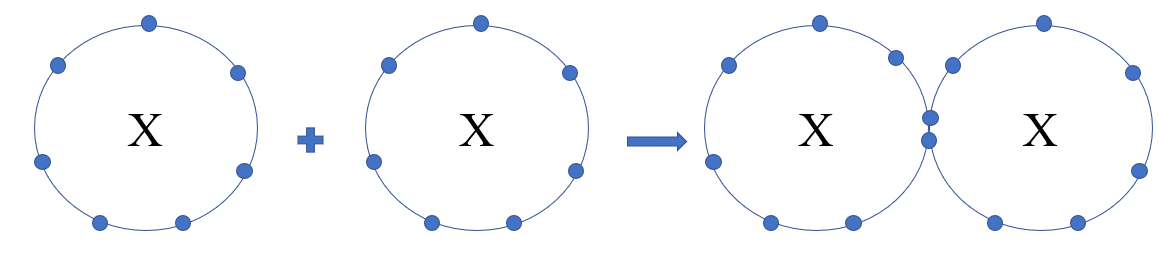
b)
- Trong phân tử halogen, liên kết hình thành giữa 2 nguyên tử giống nhau
=> Hiệu độ âm điện = 0, cặp electron dùng chung không bị hút lệch về phía nguyên tử nào
=> Liên kết cộng hóa trị không phân cực
c)
- Độ dài liên kết là khoảng cách giữa 2 hạt nhân của 2 nguyên tử
- Đi từ F đến I, bán kính nguyên tử tăng dần
=> Khoảng cách giữa 2 hạt nhân tăng dần
=> Độ dài liên kết trong dãy các phân tử halogen tăng dần

Các bài tập cùng chuyên đề
Tra cứu số liệu Bảng 6.1, Bảng 6.2 và Hình 6.2 để hoàn thành bảng mô tả một số đặc điểm cấu tạo của các nguyên tử halogen theo mẫu sau:
|
Nguyên tử |
Lớp electron ngoài cùng |
Bán kính nguyên tử |
Độ âm điện |
|
Fluorine |
? |
? |
? |
|
Chlorine |
? |
? |
? |
|
Bromine |
? |
? |
? |
|
Iodine |
? |
? |
? |
Từ bảng số liệu thu được, hãy:
a) Giải thích tại sao nguyên tử halogen có xu hướng nhận 1 electron từ nguyên tử kim loại, hoặc góp chung 1 electron với nguyên tử phi kim, để hình thành liên kết.
b) Nêu và giải thích xu hướng biến đổi bán kính nguyên tử, độ âm điện của các nguyên tử halogen. Từ đó dự đoán xu hướng biến đổi tính oxi hóa từ F đến I
c) Dựa vào cấu hình electron lớp ngoài cùng và độ âm điện, giải thích tại sao nguyên tử fluorine chỉ có số oxi hóa -1 trong các hợp chất?
Xác định số oxi hóa của chlorine trong các chất sau: Cl2, HCl, HClO, HClO2, HClO3, HClO4
Từ các số oxi hóa của chlorine, hãy giải thích tại sao Cl2 vừa có tính oxi hóa vừa có tính khử?
Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất. Viết công thức một vài hợp chất của halogen thường được dùng trong thực tế
Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim
Mô tả sự hình thành liên kết trong phân tử NaCl và HCl để minh họa
Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các halogen và giải thích.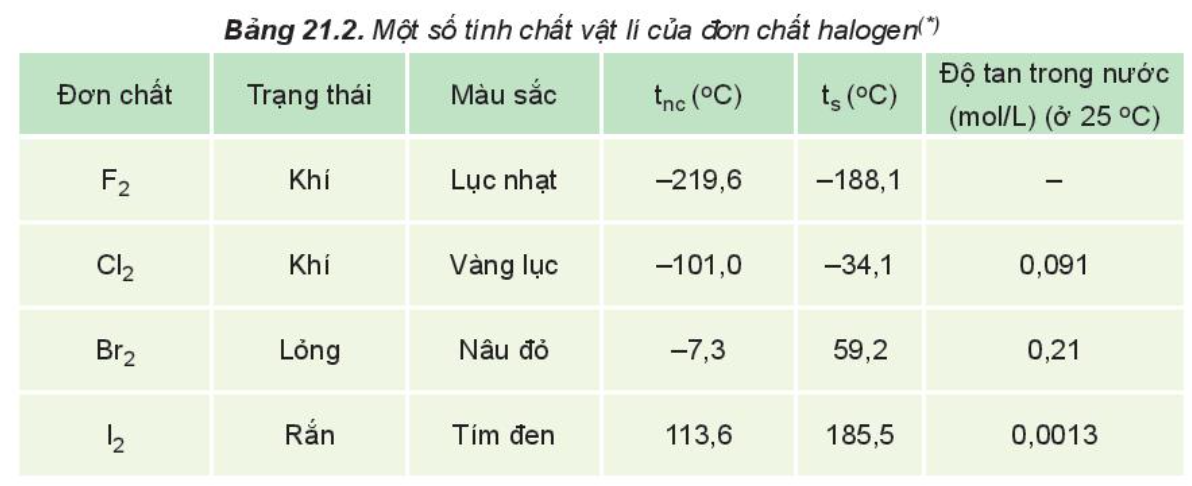
Xác định chất oxi hóa, chất khử trong phản ứng sodium và iron với chlorine, dùng mũi tên chỉ rõ sự nhường electron từ chất khử sang chất oxi hóa
Xét các phản ứng hóa học: H2(g) + X2(g) → 2HX(g) (X là các halogen)
Tra số liệu trong Bảng 12.2 để:
1. Giải thích xu hướng phản ứng của các đơn chất halogen với hydrogen theo khả năng hoạt động của các halogen
2. Dựa vào số liệu năng lượng liên kết H-X, giải thích xu hướng phản ứng giảm dần từ F2 đến I2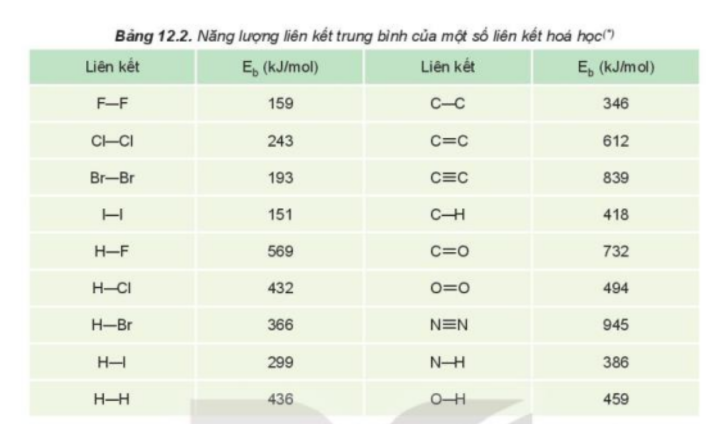
Một nhà máy nước sử dụng 5 mg Cl2 để khử trùng 1 L nước sinh hoạt. Tính khối lượng Cl2 nhà máy cần dùng để khử trùng 80 000 m3 nước sinh hoạt
Tìm hiểu tính tẩy màu của khí chlorine ẩm
Tiến hành:
Đính một mẩu giấy màu ẩm vào thanh kim loại gắn với nút đậy bình tam giác. Sau đó, đưa mầu giấy vào bình tam giác chứa khí chlorine (Hình 21.6).
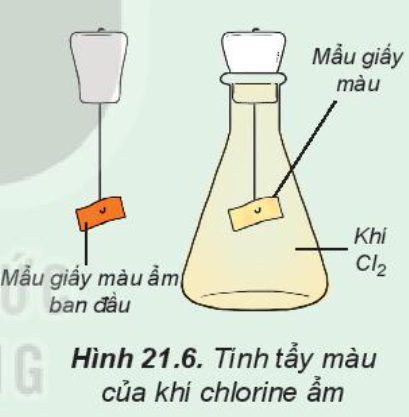
Quan sát hiện tượng và trả lời câu hỏi:
1. Nhận xét màu của mẩu giấy trước và sau khi cho vào bình tam giác. Giải thích
2. Xác định vai trò của chlorine trong phản ứng với nước, tại sao nói chlorine tự oxi hóa – tự khử trong phản ứng này?
Khí Cl2 phản ứng với dung dịch sodium hydrogen nóng tạo thành sodium chlorine, sodium chlorate và nước
Lập phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử
Phản ứng thế của một số muối halide
Chuẩn bị: 3 ống nghiệm, dung dịch NaBr, dung dịch NaI, nước Cl2, nước Br2 loãng.
Tiến hành:
- Lấy khoảng 2 mL dung dịch NaBr vào ống nghiệm (1), 2 mL dung dịch NaI vào mỗi ống nghiệm (2) và (3)
- Thêm vào ống nghiệm (1) và (2) vài giọt nước Cl2, thêm vào ống (3) vài giọt nước Br2, lắc đều các ống nghiệm
Lưu ý: Cẩn thận không để nước Cl2, nước Br2 giây ra tay, quần áo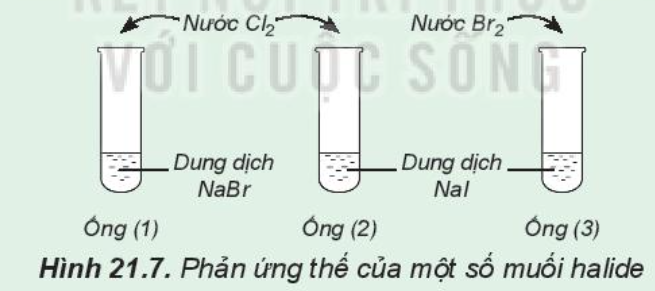
Quan sát sự thay đổi màu của dung dịch trong các ống nghiệm và trả lời câu hỏi:
1. Nhận xét sự thay đổi màu của dung dịch trong các ống nghiệm
2. So sánh tính oxi hóa của Cl2, Br2, I2
3. Hãy chọn một thuốc thử để chứng tỏ có sự tạo thành I2 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodine
Viết phương trình hóa học minh họa tính oxi hóa giảm dần trong dãy Cl2, Br2, I2
Khi sản xuất chlorine trong công nghiệp, NaOH và H2 được tạo thành ở cực âm, còn Cl2 được tạo thành từ cực dương. Tại sao cần sử dụng màng ngăn xốp để ngăn cách 2 điện cực?
Cho X, Y là hai nguyên tố halogen có trong tự nhiên, ở hai chu kì liên tiếp, ZX < ZY. Hòa tan hoàn toàn 0,402 g hỗn hợp NaX và NaY vào nước, thu được dung dịch E. Cho từ từ E vào cốc đựng dung dịch AgNO3 dư, thu được 0,574 g kết tủa.
Kí hiệu của nguyên tố X và Y lần lượt là
A. F và Cl
B. Cl và Br
C. Br và I
D. Cl và I
Khi tiến hành điều chế và thu khí Cl2 vào bình, để ngăn khí Cl2 thoát ra ngoài gây độc, cần đậy miệng bình thu khí Cl2 bằng bông có tẩm dung dịch
A. NaCl
B. HCl
C. NaOH
D. KCl
Trong dãy đơn chất từ F2 đến I2, chất có tính oxi hóa mạnh nhất là
A. F2
B. Cl2
C. Br2
D. I2
Trong nhóm halogen, từ F đến I, bán kính nguyên tử biến đổi theo chiều nào?
A. Giảm dần
B. Không đổi
C. Tăng dần
D. Tuần hoàn
Trong điều kiện thường, halogen nào ở thể rắn? Vì sao
Calcium và fluorine kết hợp thành phân tử calcium fluorine, CaF2. Trong đó, nguyên tử nào đã nhường và nhường bao nhiêu electron? Nguyên tử nào đã nhận và nhận bao nhiêu electron?
Bước 1: Chuẩn bị thí nghiệm như hình 17.1a với các ống nghiệm cùng đặt vào một giá thí nghiệm
Bước 2: Bơm vài giọt dung dịch hydrochloric acid (HCl) đặc từ xi – lanh chứa acid vào ống nghiệm chứa tinh thể potassium permanganate (thuốc tím, KMnO4) - ống nghiệm (1) để tạo khí chlorine. Khi pit – tông nâng lên khoảng ½ chiều cao của xi – lanh thu khí thì ngừng bơm acid (hình 17.1b)
Bước 3: Rút xi – lanh thu khí ra khỏi ống nghiệm (1), chuyển sang ghim vào ống nghiệm chứa kẽm - ống nghiệm (2) (hình 17.1c). Chuyển xi – lanh chứa dung dịch hydrochloric acid sang ống nghiệm (2)
Bước 4: Bơm vào giọt dung dịch hydrochloric acid từ xi – lanh chứa acid vào ống nghiệm (2) để tạo khí hydrogen. Đến khí pit – tông được nâng lên khoảng 2/3 xi – lanh thu khí thì ngừng bơm acid
Bước 5: Rút xi – lanh thu khí ra khỏi ống nghiệm (2). Ghim xi – lanh chứa hỗn hợp khí vào một nút cao su như hình 17.1d rồi kẹp vào giá thí nghiệm
Bước 6: Dùng đèn tử ngoại chiếu vào xi – lanh chứa hỗn hợp khí (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi – lanh)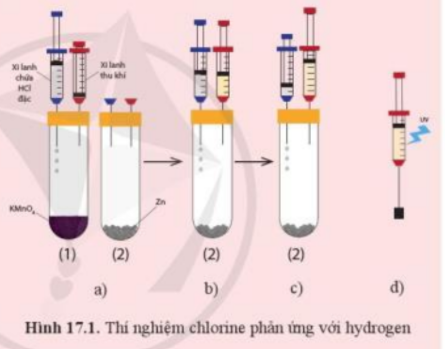
+ Quan sát và giải thích hiện tượng xảy ra khi dùng đèn tử ngoại chiếu vào xi – lanh chứa hỗn hợp khí (hoặc khi dùng ngọn lửa hơ nhẹ bên ngoài xi – lanh)
+ Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen có thể xảy ra hiện tượng như đã thấy trong thí nghiệm trên không? Giải thích
- Thí nghiệm 1:
+ Nhỏ vào ống nghiệm khoảng 2 mL dung dịch sodium bromide hoặc potassium bromide loãng.
+ Nhỏ tiếp vào ống nghiệm vài giọt nước chlorine và lắc nhẹ
+ Có thể tiếp tục nhỏ vào ống nghiệm khoảng 2 mL cyclohexane
- Thí nghiệm 2:
+ Nhỏ vào ống nghiệm khoảng 2 mL dung dịch sodium iodide hoặc potassium iodide loãng
+ Nhỏ tiếp vào ống nghiệm vài giọt nước bromine loãng và lắc nhẹ. Có thể thêm tiếp vào ống nghiệm khoảng 2 mL cyclohexane
+ Thêm tiếp vào ống nghiệm vài giọt hồ tinh bột
Giải thích các hiện tượng xảy ra và minh họa bằng phương trình hóa học
Chuẩn bị thí nghiệm như hình 17.2
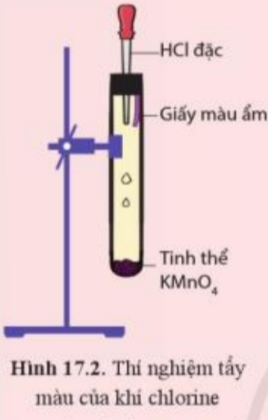
Bóp nhẹ phần cao su của ống nhỏ giọt để dung dịch hydrochloric acid chảy xuống ống nghiệm. Quan sát các hiện tượng xảy ra và giải thích.
Hãy viết phương trình hóa học để chứng minh chlorine có tính oxi hóa mạnh hơn bromine
Trong công nghiệp, dung dịch sodium chlorine được đem điện phân để có phản ứng theo phương trình hóa học sau:
NaCl (aq) + H2O (l) → A (aq) + X (g) + Y (g) (*)
Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến.
Từ phản ứng kết hợp giữa X và Y sẽ sản xuất được hydrogen chlorine
a) Hãy cho biết công thức hóa học của A, X, Y
b) Hoàn thành phương trình hóa học (*)
Astatine là nguyên tố phóng xạ, được xếp dưới nguyên tố iodine trong nhóm VIIA. Thực tế, các nhà khoa học chỉ thu được đồng vị bền của astatine từ quá trình nghiên cứu về phóng xạ, đồng thời nó chỉ tồn tại khoảng 8 giờ
Dựa vào xu hướng biến đổi một số tính chất của nhóm halogen, hãy dự đoán:
a) Tính oxi hóa của nguyên tử astatine mạnh hơn hay yếu hơn so với nguyên tử iodine?
b) Đơn chất astatine có màu đậm hơn hay nhạt hơn so với đơn chất iodine?
Tra cứu các giá trị năng lượng liên kết ở phụ lục 2
a) Hãy tính biến thiên enthalpy chuẩn ∆rH0298 của 2 phản ứng dưới đây:
F2(g) + H2(g) → 2HF (g)
O2(g) + 2H2(g) → 2H2O(g)
b) Ở hai phản ứng trên, fluorine và oxygen đều đóng vai trò là chất oxi hóa. Dựa vào giá trị ∆rH0298, cho biết phản ứng oxi hóa – khử nào thuận lợi hơn
Một trong những ứng dụng của chlorine trong đời sống là khử trùng nước sinh hoạt tại các nhà máy xử lí và cấp nước. Trong quá trình khử trùng, người ta phải cho một lượng chlorine dư vào nước sinh hoạt. Lượng chlorine dư trong nước sinh hoạt còn có tác dụng ngăn ngừa sự tái nhiễm của vi khuẩn trong quá trình phân phối trong đường ống dẫn nước và trữ nước tại nhà.
Theo quy chuẩn kĩ thuật quốc gia (QCVN 01 – 1: 2018/BYT), hàm lượng chlorine tự do đối với nước sạch sử dụng cho mục đích sinh hoạt từ 0,2 – 1 mgL-1. Nếu hàm lượng chlorine nhỏ hơn 0,2 – 1 mgL-1 thì không tiêu diệt hết vi khuẩn và không xử lí được hết chất hữu cơ. Ngược lại, lượng chlorine trong nước lớn hơn 1,0 mgL-1 sẽ gây dị ứng
Carbon trong than hoạt tính sẽ tương tác trực tiếp với chlorine, giúp loại bỏ chlorine và các hợp chất chlorine và các hợp chất chlorine bằng cơ chế hấp thụ bề mặt. Khi chiếu tia cực tím với cường độ cao vào nước cũng làm giảm lượng chlorine. Các máy lọc nước RO (reverse osmosis: thẩm thấu ngược) cũng có thể giúp loại bỏ lượng chlorine trong nước một cách hiệu quả
Hãy trả lời các câu hỏi sau đây:
a) Dấu hiệu nào cho thấy chlorine có trong nước sinh hoạt
b) Vì sao người ta cần cho chlorine đến dư vào nước sinh hoạt
c) Cho biết một số phương pháp có thể loại bỏ khí chlorine dư trong nước sinh hoạt







Danh sách bình luận