Xác định thành phần nguyên tử (số proton, neutron, electron) của mỗi đồng vị sau:
a) \({}_{14}^{28}Si\), \({}_{14}^{29}Si\), \({}_{14}^{30}Si\)
b) \({}_{26}^{54}Fe\), \({}_{26}^{56}Fe\), \({}_{26}^{57}Fe\), \({}_{26}^
- Kí hiệu một nguyên tử cho biết:
+ Kí hiệu của nguyên tố đó
+ Số hiệu nguyên tử = số proton = số electron
+ Số neutron = số khối – số proton
a)
|
\({}_{14}^{28}Si\) |
- Số hiệu nguyên tử = số proton = số electron = 14 - Số neutron = 28 – 14 = 14 |
|
\({}_{14}^{29}Si\) |
- Số hiệu nguyên tử = số proton = số electron = 14 - Số neutron = 29 – 14 = 15 |
|
\({}_{14}^{30}Si\) |
- Số hiệu nguyên tử = số proton = số electron = 14 - Số neutron = 30 – 14 = 16 |
b)
|
\({}_{26}^{54}Fe\) |
- Số hiệu nguyên tử = số proton = số electron = 26 - Số neutron = 54 – 26 = 28 |
|
\({}_{26}^{56}Fe\) |
- Số hiệu nguyên tử = số proton = số electron = 26 - Số neutron = 56 – 26 = 30 |
|
\({}_{26}^{57}Fe\) |
- Số hiệu nguyên tử = số proton = số electron = 26 - Số neutron = 57 – 26 = 31 |
|
\({}_{26}^{58}Fe\) |
- Số hiệu nguyên tử = số proton = số electron = 26 - Số neutron = 58 – 26 = 32 |

Các bài tập cùng chuyên đề
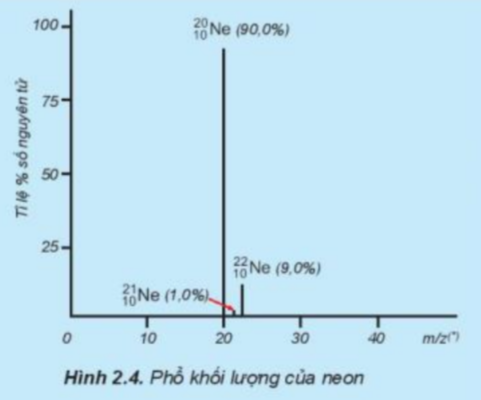
Tỉ lệ phần trăm số nguyên tử các đồng vị của neon (Ne) được xác định theo phổ khối lượng (Hình 2.4). Tính nguyên tử khối trung bình của Ne.
Cho các nguyên tử sau:
\({}_2^5X\), \({}_3^7Y\), \({}_4^9Z\), \({}_5^{11}M\), \({}_5^{12}T\)
Những nguyên tử nào là đồng vị của nhau?
Nguyên tố oxygen có 17 đồng vị, bắt đầu từ \({}_8^{12}O\), kết thúc là \({}_8^{28}O\). Các đồng vị oxygen có tỉ lệ giữa số hạt neutron (N) và số hiệu nguyên tử thỏa mãn \(1 \leqslant \frac{N}{Z} \leqslant 1,25\)thì bền vững. Hỏi trong tự nhiên thường gặp đồng vị nào của oxygen?
Em hãy tìm hiểu đồng vị nào của oxygen chiếm tỉ lệ lớn nhất trong tự nhiên.
Trong tự nhiên, argon có các đồng vị \({}^{40}{\text{Ar}}\),\(^{38}{\text{Ar}}\), \({}^{36}{\text{Ar}}\)chiếm tương ứng khoảng 99,604%; 0,063% và 0,333% số nguyên tử. Tính nguyên tử khối trung bình của Ar.
Trong tự nhiên, đồng có hai đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính số mol mỗi loại đồng vị có trong 6,354 gam đồng
Phổ khối, hay phổ khối lượng (MS: Mass Spectrum) chủ yếu được sử dụng để xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Phổ khối của neon được biểu diễn như ở Hình 3.5.
Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đồng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng +1).
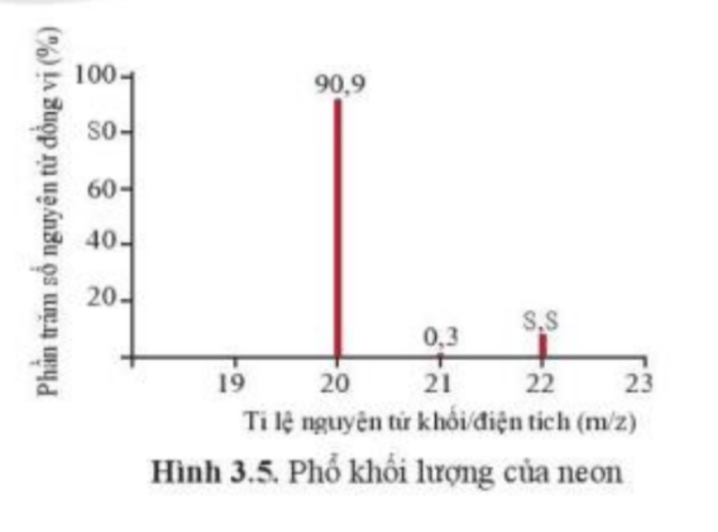 a) Neon có bao nhiêu đồng vị bền?
a) Neon có bao nhiêu đồng vị bền?
b) Tính nguyên tử khối trung bình của Neon.
Trong tự nhiên, nguyên tố copper có hai đồng vị với phần trăm số nguyên tử tương ứng là \({}_{29}^{63}Cu\) (69,15%) và \({}_{29}^{65}Cu\) (30,85%). Hãy tính nguyên tử khối trung bình của nguyên tố copper
Trong thể dục thể thao, có một số vận động viên sử dụng các loại chất kích thích trong thi đấu, gọi là doping, dẫn đến thành tích đạt đưuọc của họ không thật so với năng lực vốn có. Một trong các loại doping thường gặp nhất là testosterone tổng hợp
Tỉ lệ giữa hai đồng vị \({}_6^{12}C\) (98,98%) và \({}_6^{13}C\) (1,11%) là không đổi đối với testosterone tự nhiên trong cơ thể, Trong khi testosterone tổng hợp (tức doping) có phần trăm số nguyên tử đồng vị \({}_6^{13}C\) ít hơn testosterone tự nhiên. Đây chính là mấu chốt của xét nghiệm CIR (Carbon Isotope Ratio – Tỉ lệ đồng vị carbon) – một xét nghiệm với mục đích xác định xem vận động viên có sử dụng doping hay không.
Giả sử, thực hiện phân tích CIR đối với một vận động viên thu được kết quả phần trăm số nguyên tử đồng vị \({}_6^{12}C\) là x và \({}_6^{13}C\) là y. Từ tỉ lệ đó, người ta tính được nguyên tử khối trung bình của carbon trong mẫu phân tích có giá trị là 12,0098. Với kết quả thu được, em có nghi ngờ vận động viên này sử dụng doping hay không? Vì sao?
Trong tự nhiên, magnesium có 3 đồng vị bền là 24Mg, 25Mg và 26Mg. Phương pháp phổ khối lượng xác nhận đồng vị 26Mg chiếm tỉ lệ phần trăm số nguyên tử là 11%. Biết rằng nguyên tử khối trung bình của Mg là 24,32. Tính % số nguyên tử của đồng vị 24Mg, đồng vị 25Mg?
Đồng vị phóng xạ cobalt (Co-60) phát ra tia γ có khả năng đâm xuyên mạnh, dùng điều trị các khối u ở sâu trong cơ thể. Cobalt có ba đồng vị: \({}_{27}^{59}Co\) (chiếm 98%), \({}_{27}^{58}Co\) và \({}_{27}^{60}Co\); nguyên tử khối trung bình là 58,982. Xác định hàm lượng % của đồng vị phóng xạ Co-60.
Boron là nguyên tố có nhiều tác dụng đối với cơ thể người như làm lành vết thương, điều hòa nội tiết sinh dục, chống viêm khớp,... Do ngọn lửa cháy có màu lục đặc biệt nên boron vô định hình được dùng làm pháo hoa. Boron có hai đồng vị là 10B và 11B, nguyên tử khối trung bình là 10,81. Tính phần trăm số nguyên tử mỗi đồng vị của boron.
Nguyên tố R có hai đồng vị, nguyên tử khối trung bình là 79,91. Một trong hai đồng vị là \({}_{}^{79}R\)(chiếm 54,5%). Nguyên tử khối của đồng vị thứ hai là
A. 80.
B. 81.
C. 82.
D. 80,5.
Oxygen có ba đồng vị với tỉ lệ % số nguyên tử tương ứng là \({}_{}^{16}O\) (99,757%), \({}_{}^{17}O\)(0,038%) và \({}_{}^{18}O\)(0,205%). Nguyên tử khối trung bình của oxygen là
A. 16,0.
B. 16,2.
C. 17,0.
D. 18,0.
Trong tự nhiên, bromine có hai đồng vị bền là \({}_{35}^{79}Br\) chiếm 50,69% số nguyên tử và \({}_{35}^{81}Br\) chiếm 49,31% số nguyên tử. Nguyên tử khối trung bình của bromine là
A. 80,00.
B. 80,112.
C. 80,986.
D. 79,986.
Nitrogen có hai đồng vị bền là \({}_7^{14}N\) và \({}_7^{15}N\). Oxygen có ba đồng vị bền là \({}_8^{16}O\), \({}_8^{17}O\) và \({}_8^{18}O\). Số hợp chất NO2 tạo bởi các đồng vị trên là
A. 3.
B. 6.
C. 9.
D. 12.
Đồng vị được sử dụng rộng rãi để nghiên cứu phản ứng hóa học. Cho biết vai trò của D (đồng vị \({}_1^2H\)) và T (đồng vị \({}_1^3H\)) là như nhau trong các phản ứng hóa học. Trong điều kiện thích hợp, xảy ra phản ứng sau:
CH2=CH-CH2-CH2-CH=CHD ⇌ CH2=CH-CH2-CHD-CH=CH2 (1)
Vậy cũng trong điều kiện đó, phản ứng sau đây có xảy ra không?
CD2=CD-CD2-CD2-CD=CDT ⇌ CD2=CD-CD2-CDT-CD=CD2 (2)
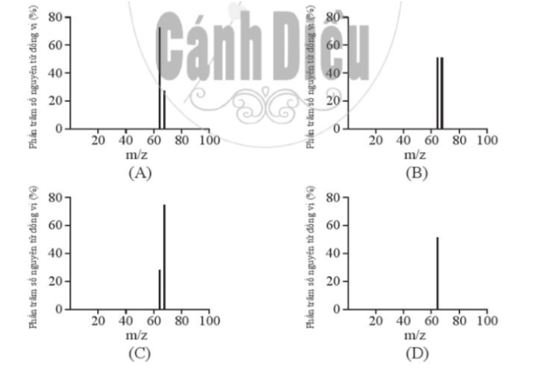
Đồng có hai đồng vị bền trong tự nhiên là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,55 (điện tích z của các ion đồng vị đồng đều bằng 1+). Hình vẽ phổ khối nào dưới đây là đúng?
Bạc có hai đồng vị bền trong tự nhiên: 107Ag có hàm lượng tương đối là 51,8%; 109Ag có hàm lượng tương đối là 48,2%. Hãy vẽ phổ khối lượng của bạc và tính nguyên tử khối trung bình của Ag.
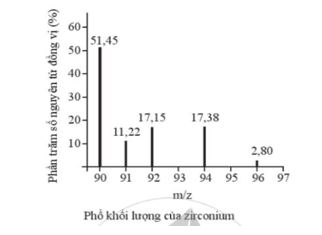
Phổ khối lượng của zirconium được biểu diễn như hình sau đây (điện tích z của các đồng vị zirconium đều bằng 1+).
Số lượng đồng vị bền và nguyên tử khối trung bình của zirconium là
A. 5 đồng vị, nguyên tử khối trung bình bằng 92,60.
B. 5 đồng vị, nguyên tử khối trung bình bằng 91,32.
C. 4 đồng vị, nguyên tử khối trung bình bằng 91,18.
D. 4 đồng vị, nguyên tử khối trung bình bằng 92,00.
Trong tự nhiên, carbon có hai đồng vị bền là 12C và 13C; oxygen có ba đồng vị bền là 16O; 17O và 18O. Số lượng tối đa loại phân tử CO2 có thể tạo ra từ các đồng vị này là
A. 6. B. 9. C. 12. D. Vô số.
Neon có ba đồng vị bền trong tự nhiên. Tỉ lệ phần trăm số nguyên tử mỗi đồng vị được thể hiện trong bảng sau:
|
Số khối |
A |
21 |
22 |
|
Tỉ lệ (%) |
90,9 |
0,3 |
8,8 |
Biết rằng nguyên tử khối trung bình của Ne là 20,18. Giá trị số khối A của đồng vị đầu tiên là
A. 19,00. B. 20,00.
C. 20,01. D. Không xác định được.
Phổ khối lượng của một mẫu lithium cho thấy nó chứa hai đồng vị là 6Li và 7Li với tỉ lệ phần trăm số nguyên tử của mỗi đồng vị lần lượt là 7,42% và 92,58%. Nguyên tử khối trung bình của mẫu lithium này (kết quả tính đến hai chữ số thập phân) là
A. 6,07. B. 6,50. C. 6,90. D. 6,93.
Trong tự nhiên, hydrogen có ba đồng vị (\({}_1^1H\);\({}_1^1H\);\({}_1^1H\)). Nguyên tử khối trung bình của hydrogen bằng 1,008. Hãy cho biết đồng vị nào của hydrogen chiếm tỉ lệ nhiều nhất trong tự nhiên.
A. \({}_1^1H\).
B. \({}_1^2H\).
C. \({}_1^3H\).
D. Không thể xác định được.
Hãy so sánh:
a) Số lượng hợp chất và số lượng nguyên tố.
b) Số lượng nguyên tố và số lượng đồng vị. Giải thích.
Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau:
|
Đồng vị |
24Mg |
25Mg |
26Mg |
|
% |
78,6 |
10,1 |
11,3 |
Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg, số nguyên tử tương ứng của hai đồng vị 24Mg và 26Mg lần lượt là
A. 389 và 56.
B. 56 và 389.
C. 495 và 56.
D. 56 và 495.







Danh sách bình luận