Quan sát Hình 4.2, giải thích hiện tượng thí nghiệm. Từ đó cho biết tại sao không thu khí ammonia bằng phương pháp đẩy nước.
Khí ammonia tan nhiều trong nước.
NH3 (ammonia) là dung dịch có tính base theo thuyết acid – base của Brosted – Lowry. Dung dịch ammonia làm quỳ tím hóa xanh, phenolphthalein hóa hồng.
Thu khí bằng phương pháp đẩy nước áp dụng cho những chất khí không tan hoặc ít tan trong nước.
Khí ammonia tan nhiều trong nước. làm áp suất trong bình khí chứa ammonia giảm, hút nước có pha phenolphthalein lên bình, phun thành tia; khí ammonia có tính base, làm phenolphthalein hóa hồng nên các tia nước phun lên có màu hồng.
Vì khí ammonia tan nhiều trong nước, nên không thể sử dụng phương pháp đẩy nước để thu khí ammonia.

Các bài tập cùng chuyên đề
1. Viết cấu hình electron của các nguyên tử H (Z = 1) và N (Z = 7).
2. Trình bày các bước lập công thức Lewis của phân tử ammonia.
Từ đặc điểm cấu tạo của phân tử ammonia, hãy giải thích tại sao các phân tử ammonia có khả năng tạo liên kết hydrogen mạnh với nhau.
Hãy giải thích tại sao ammonia tan tốt trong nước
Phân tử ammonia có dạng hình học nào sau đây?
A. Chóp tam giác. B. Chữ T. C. Chóp tứ giác. D. Tam giác đều.
Khi so sánh phân tử ammonia với ion ammonium, nhận định nào sau đây là đúng?
A. Đều chứa liên kết ion. B. Đều có tính acid yếu trong nước.
C. Đều có tính base yếu trong nước. D. Đều chứa nguyên tử N có số oxi hoá là -3.
Ammonia là một hợp chất của hydrogen và nitrogen, có rất nhiều ứng dụng trong đời sống và sản xuất. Ammonia có những tính chất và ứng dụng gì?
Tính tỉ khối của NH3 so với không khí. Từ kết quả đó, hãy giải thích vì sao có thể thu khí NH3 bằng phương pháp đẩy không khí (úp ngược bình).
A. cộng hoá trị có cực. C. cộng hoá trị không cực.
B. ion. D. kim loại.
Khi làm lạnh hỗn hợp khí gồm ammonia, hydrogen và nitrogen thì ammonia sẽ hoá lỏng trước. Tính chất vật lí nào của các chất giúp giải thích hiện tượng trên?
Sự phụ thuộc của độ tan khí ammonia trong nước vào nhiệt độ được mô tả ở hình bên. Dựa vào đồ thị ở hình bên, hãy xác định:
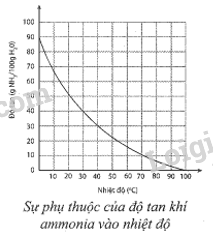
a) Độ tan của ammonia ở 30 °C. Nhận xét về tính tan của ammonia ở nhiệt độ này.
b) Nồng độ phần trăm của dung dịch ammonia bão hoà ở 30 °C.
c) Độ tan của ammonia ở 60 °C. So sánh với độ tan của ammonia ở 30 °C. Giải thích.
Cho các nhận định sau: Phân tử ammonia và ion ammonium đều (1) chứa liên kết cộng hoá trị; (2) là base Bronsted trong nước; (3) là acid Bronsted trong nước; (4) chứa nguyên tử N có số oxi hoá là –3.
Số nhận định đúng là
A.2. B. 1. C. 4. D. 3.
Khí nào sau đây dễ tan trong nước do tạo được liên kết hydrogen với nước?
A. Nitrogen. B. Hydrogen. C. Ammonia. D. Oxygen.
Ở trạng thái lỏng nguyên chất, phân tử chất nào sau đây tạo được liên kết hydrogen với nhau?
A. Nitrogen. B. Ammonia. C. Oxygen. D. Hydrogen.
Liên kết trong phân tử NH3 là
A. liên kết cộng hoá trị phân cực.
C. liên kết cộng hoá trị không phân cực.
B. liên kết ion.
D. liên kết hydrogen.
Trong các công thức dưới đây, có bao nhiêu công thức không thỏa mãn quy tắc octet?
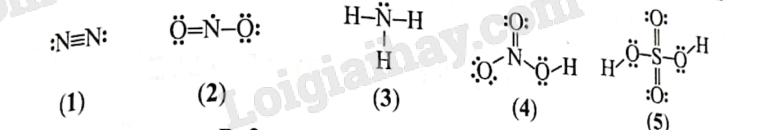
A. 1.
B. 2.
C. 3.
D. 4.
5.1 Nối tính chất của ammonia của cột A với các biểu hiện tính chất ở cột B cho phù hợp
|
Cột A |
Cột B |
|
a) Tính chất vật lí |
1. Làm quỳ tím hóa xanh 2. Tan trong nước tạo môi trường có pH >7 |
|
b) Tính base |
3. Tan vô hạn trong nước |
|
c) Tính khử |
4. Phản ứng với acid tạo muối ammonium |
|
|
5. Phản ứng với oxygen |
|
|
6. Phản ứng với một số oxide kim loại tạo ra kim loại và khí nitrogen |
Chất nào sau đây được sử dụng là chất làm lạnh trong các hệ thống làm lạnh công nghiệp?
A. N2. B. NH3. C. SO2. D. S.
Ammonia có tính chất vật lí nào sau đây?
-
A.
Tan tốt trong nước.
-
B.
Có màu nâu đỏ.
-
C.
Không tan trong nướ
-
D.
Có màu xanh tím.
A. Nitrogen
B. Hydrogen
C. Ammnonia
D. Oxygen
A. Trong điều kiện thường, NH3 là khí không màu, mùi khai
B. Khí NH3 nhẹ hơn không khí
C. Phân tử NH3 chứa các liên kết cộng hóa trị không phân cực
D. Khí NH3 tan nhiều trong nước
Xét cấu tạo của phân tử NH3.
Phân tử NH3 có dạng chóp tam giác gồm 1 nguyên tử N ở đỉnh liên kết với 3 nguyên tử H ở đáy.
Trong NH3 chứa 3 liên kết N – H là các liên kết cộng hóa trị phân cực về phía H.
Trong NH3, nguyên tử N còn cặp electron chưa tham gia liên kết.
Giữa các phân tử NH3 có liên kết hydrogen.
Liên kết hoá học trong phân tử NH3 là liên kết
-
A.
cộng hoá trị có cực.
-
B.
ion.
-
C.
cộng hoá trị không cực.
-
D.
kim loại.
Ammonia (NH3) là nguyên liệu để sản xuất nitric acid và nhiều loại phân bón. Số oxi hóa của nitrogen (N) trong ammonia là
-
A.
+3.
-
B.
–3.
-
C.
+1.
-
D.
–1.
Trong công thức Lewis của phân tử NH3, số cặp electron tự do trên nguyên tử N là
-
A.
0.
-
B.
2.
-
C.
1
-
D.
3







Danh sách bình luận