Quan sát Bảng 18.4, nhận xét về xu hướng biến đổi độ bền nhiệt của muối carbonate từ MgCO3 đến BaCO3.
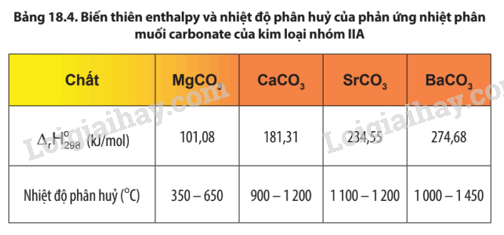
Độ bền nhiệt của muối carbonate của kim loại nhóm IIA có xu hướng tăng dần từ muối của MgCO3 đến muối của BaCO3.

Các bài tập cùng chuyên đề
Các muối carbonate của kim loại nhóm IIA đều bị phân huỷ bởi nhiệt:
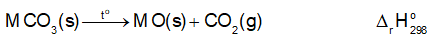
Biến thiên enthalpy chuẩn của quá trình trên được cho trong bảng sau

Thực hiện các yêu cầu sau:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán xu hướng biến đổi độ bền nhiệt của các muối carbonate của kim loại nhóm IIA.
Biến thiên enthalpy chuẩn của phản ứng nhiệt phân các muối nitrate của kim loại nhóm IIA:
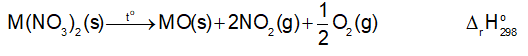
Cho trong bảng sau:

Thực hiện yêu cầu sau:
Dựa vào biến thiên enthalpy chuẩn của phản ứng, dự đoán xu hướng biến đổi độ bền nhiệt của muối nitrate của kim loại nhóm IIA.
Trong công nghiệp, quá trình nung vôi được thực hiện theo phản ứng:
\({\rm{CaC}}{{\rm{O}}_{\rm{3}}}{\rm{(s)}} \to {\rm{CaO(s)}} + {\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{(g) }}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = 179,2{\rm{ kJ}}\)
a) Cho biết quá trình nung vôi là quá trình toả nhiệt hay quá trình thu nhiệt.
b) Trình bày một số ứng dụng chính của sản phẩm nung vôi.
c) Nêu một số tác hại của quá trình nung vôi thủ công đối với môi trường.
Trình bày cách phân biệt dung dịch CaCl2 và dung dịch BaCl2 bằng màu ngọn lửa và bằng phương pháp hoá học.
Độ bền nhiệt trong dãy muối carbonate từ MgCO3 đến BaCO3 biến đổi như thế nào?
A. Tăng dần. B. Giảm dần.
C. Không có quy luật. D. Không đổi.
Độ tan trong dãy muối sulfate từ MgSO4 đến BaSO4 biến đổi như thế nào?
A. Tăng dần. B. Giảm dần.
C. Không có quy luật. D. Không đổi.
So sánh độ tan của muối BaSO4 và CaSO4
Chuẩn bị:
- Hóa chất: Dung dịch BaCl2, CaCl2 cùng nồng độ 0,1M; dung dịch CuSO4 5%.
- Dụng cụ: ống nghiệm, ống hút nhỏ giọt
Tiến hành: Cho 2ml dung dịch BaCl2 vào ống nghiệm (1), 2ml dung dịch CaCl2 vào ống nghiệm (2). Cho từ từ từng giọt dung dịch CuSO4 vào mỗi ống nghiệm và lắc đều cho đến khi có kết tủa trong ống nghiệm thì dừng lại
Yêu cầu: Quan sát hiện tượng, so sánh thời điểm xuất hiện kết tủa trong mỗi ống nghiệm, giải thích.
Phản ứng giữa các chất nào sau đây tạo ra chất không tan?
a) K2CO3 + Ca(OH)2 \( \to \)?
b) H2SO4 + NaOH \( \to \)?
c) HNO3 + Mg(OH)2 \( \to \)?
d) Na2SO4 + Ba(OH)2 \( \to \)?
Vì sao các khoáng vật calcite, dolomite,… hầu như không tan trong nước?
Dùng nước có thể phân biệt MgCO3(s) và Mg(NO3)2(s) được không. Giải thích.
Một mẫu nước giếng có chứa các ion Ca2+, Na+, Mg2+, Cl- và SO42-. Viết phương trình hóa học của các phản ứng tạo chất không tan khi cho dung dịch soda vào mẫu nước giếng trên.
Vì sao khi có sự gia tăng nồng độ của carbon dioxide trong nước biển thì các rạn san hô và núi đá vôi có thể bị phá hủy xói mòn?
Dựa vào Bảng 18.4, hãy cho biết quá trình phân hủy 1 mol muối carbonate của nguyên tố nhóm IIA nào cần hấp thu nhiều năng lượng hơn.
Thí nghiệm kiểm tra sự có mmặt của các ion Ca2+, Ba2+, SO42-, CO32-
Chuẩn bị:
- Hóa chất: Dung dịch CaCl2 0,1M; Na2CO3 0,1M; HCl 1,0M
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt
Tiến hành: Cho vào ống nghiệm khoảng 2ml dung dịch CaCl2, thêm từ từ cho đến hết khoảng 10 giọt dung dịch Na2CO3. Tiếp tục thêm vào khoảng 10 giọt dung dịch HCl, lắc đều
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Thí nghiệm kiểm tra sự có mặt của ion Ba2+ trong dung dịch
Chuẩn bị:
- Hóa chất: Dung dịch BaCl2 0,1M; H2SO4 0,1M
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt
Tiến hành: Cho vào ống nghiệm khoảng 2 ml dung dịch BaCl2, thêm từ từ cho đến hết khoảng 6 – 8 giọt dung dịch H2SO4, lắc đều
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Thí nghiệm kiểm tra sự có mặt của ion SO42- trong dung dịch
Chuẩn bị:
- Hóa chất: Dung dịch ZnSO4 0,1M; BaCl2 0,1M; HCl 1,0M.
- Dụng cụ: ống nghiệm, ống hút nhỏ giọt
Tiến hành: Cho vào ống nghiệm khoảng 2ml dung dịch ZnSO4, thêm từ từ cho đến hết khoảng 10 giọt dung dịch BaCl2, lắc ống nghiệm. Tiếp theo thêm vào khoảng 2 – 3 giọt dung dịch HCl, lắc đều.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Thí nghiệm kiểm tra sự có mặt của ion CO32- trong dung dịch
Chuẩn bị
- Hóa chất: Dung dịch Na2CO3 1,0M, HCl 1M.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt, giất chỉ thị pH
Tiến hành: Cho vào ống nghiệm khoảng 1ml dung dịch Na2CO3. Dùng giấy chỉ thị PH để kiểm tra môi trường dung dịch. Thêm tiếp 2 ml dung dịch HCl vào ống nghiệm, lắc đều, đưa que diêm đang cháy đến miệng ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng và viết phương trình hóa học của phản ứng xảy ra.
Khi cho lượng soda phù hợp vào dung dịch có chứa cation Ca2+ và Mg2+ thì hai cation này sẽ bị tách ra khỏi dung dịch. Viết phương trình hóa học minh họa.
Đề xuất phương án phân biệt các dung dịch không màu CaCl2, BaCl2, KCl, NaCl và Na2CO3
Dự đoán khả năng phản ứng của muối carbonate kim loại nhóm IIA với dung dịch acid loãng.
Quan sát Bảng 18.5, nhận xét xu hướng biến đổi độ bền nhiệt của muối nitrate. Từ đó rút ra mối quan hệ giữa độ bền nhiệt và giá trị biến thiên enthalpy của phản ứng nhiệt phân muối nitrate kim loại nhóm IIA.
Hoàn thành phương trình hoá học của các phản ứng sau:
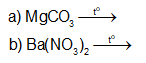
Giải thích và viết phương trình hoá học của các phản ứng xảy ra trong quá trình sau:
a) Vôi sống tiếp xúc lâu ngày trong không khí sẽ bị giảm chất lượng.
b) Trên bể mặt các hố vôi tôi lâu ngày thường có màng chất rắn.
Thực hiện Thí nghiệm 1 theo hướng dẫn, nêu hiện tượng xảy ra. Rút ra kết luận về độ tan của các muối sulfate. Giải thích.
Thực hiện Thí nghiệm 2 theo hướng dẫn, nêu hiện tượng xảy ra. Viết phương trình hoá học của các phản ứng xảy ra và giải thích.
Trình bày cách phân biệt 3 dung dịch không màu Na2CO3, K2SO4, Ba(NO3)2 bằng phương pháp hóa học.
Vẽ sơ đồ tư duy để nêu một số ứng dụng của đơn chất và hợp chất của kim loại nhóm IIA.
Viết các phương trình hoá học cho các phản ứng sau:
a) Calcium oxide tác dụng với dung dịch hydrochloric acid loãng.
b) Dung dịch sodium carbonate tác dụng với dung dịch calcium hydroxide.
Y là hợp chất của calcium có nhiều ở dạng đá vôi, đá hoa,... Hợp chất Z có trong thành phần không khí và thường dùng để chữa cháy. Biết Z được sinh ra khi cho Y phản ứng với dung dịch acid mạnh. Xác định Y và Z, viết phương trình hoá học của phản ứng.
Vôi sống sau khi được sản xuất phải được bảo quản trong bao kín. Nếu để lâu ngày trong không khí, vôi sống sẽ “chết “. Phản ứng nào dưới đây giải thích hiện tượng vôi “chết “.
-
A.
Ca(HCO3)2→ CaCO3 + CO2 + H2O.
-
B.
Ca(OH)2 + CO2→ CaCO3 +H2O
-
C.
CaCO3 + CO2 + H2O→Ca(HCO3)2
-
D.
CaO + CO2 → CaCO3







Danh sách bình luận