Giải thích tại sao NaHCO3 được dùng làm bột nở.
Sodium hydrogencarbonate (hay sodium bicarbonate, NaHCO3) còn được gọi là baking soda, là chất rắn màu trắng, bền ở nhiệt độ thường, bị phân huỷ khi đun nóng.
NaHCO3 được dùng làm bột nở vì:
+ Dưới tác dụng của nhiệt độ, muối sodium bicarbonate bị nhiệt phân:
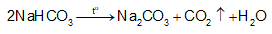
+ Quá trình nhiệt phân tạo khí CO2 và hơi nước giúp bánh nở và xốp.

Các bài tập cùng chuyên đề
a) Trong quá trình Solvay, viết các phương trình hoá học của phản ứng:
- Nung vôi để cung cấp vôi sống và carbon dioxide.
- Tái chế ammonia từ vôi sống và dung dịch ammonium chloride.
b) Quy trình Solvay đã giảm thiểu được tác động đến môi trường bằng cách quay vòng các sản phẩm trung gian (như CO2 và NH3) để tái sử dụng trong quy trình sản xuất.
Từ sơ đồ quá trình Solvay, hãy làm sáng tỏ nhận định trên.
Trong thực tiễn, sodium carbonate có một số ứng dụng.
1. Tách loại ion Mg2+ và Ca2+ ra khỏi nước (để làm mềm nước).
2. Tách loại ion Fe3+ ra khỏi nước ở dạng kết tủa Fe(OH)3 (để xử lí nước nhiễm phèn).
Viết phương trình hoá học để giải thích các ứng dụng trên.
Viết các phương trình hoá học để giải thích cơ sở các ứng dụng sau:
a) Viên sủi chứa NaHCO3 và acid hữu cơ (viết gọn là HX) có khả năng tạo bọt khí khi hoà tan vào nước.
b) Trong kĩ thuật xử lí nước, NaHCO3 được sử dụng để điều chỉnh pH khi nước dư acid (H+).
NaHCO3 là hợp chất kém bền nhiệt, bắt đầu bị phân huỷ ở khoảng 120 °C:
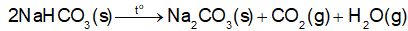
Trong thực tiễn, NaHCO3 được sử dụng làm bột nở trong chế biến thực phẩm và làm chất chữa cháy dạng bột. Giải thích cơ sở của các ứng dụng đó.
Viết các quá trình oxi hoá, quá trình khử xảy ra ở mỗi điện cực và viết phương trình hoá học của quá trình điện phân dung dịch NaCl có màng ngăn.
\({\rm{NaCl}} + {\rm{N}}{{\rm{H}}_{\rm{3}}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NaHC}}{{\rm{O}}_{\rm{3}}} + {\rm{N}}{{\rm{H}}_{\rm{4}}}{\rm{Cl}}\)
Khi làm lạnh dung dịch trên, muối bị tách ra khỏi dung dịch là
A. NaHCO3 B. NH4Cl. C. NaCl. D. NH4HCO3.
Nguyên tố nhóm IA và một số hợp chất của chúng có nhiều ứng dụng trong thực tiễn (Hình 17.1)
a) Nêu một số ứng dụng của đơn chất và hợp chất của nguyên tố nhóm IA mà em biết.
b) Kim loại nhóm IA có những tính chất vật lí và tính chất hóa học đặc trưng nào?
Ống dẫn nước của bồn rửa bát thường có dầu, mỡ bám vào. Tìm hiểu để giải thích vì sao nên dùng soda, không nên dùng baking soda để tẩy rửa lớp bám này.
Nêu một số lợi ích của việc tái tạo và tái sử dụng ammonia trong phương pháp Solvay.
Thí nghiệm: Phân biệt cation Li+, Na+, K+
Nhúng đầu que đốt bằng platium đã được rửa sạch bằng nước vào dung dịch lithium chloride nồng độ khoảng 25% rồi đưa lên ngọn lửa đèn khí.
Thực hiện thao tác tương tự đối với mỗi dung dịch sodium chloride 25% và dung dịch potassium chloride 25%
Yêu cầu: Nêu hiện tượng quan sát được.
Dung dịch của mỗi chất sau đều không màu: NaCl, Na2SO4, KCl, LiNO3. Hãy để xuất cách phân biệt các dung dịch trên.
Sử dụng sơ đồ tư duy, trình bày các sản phẩm cơ bản của công nghiệp chlorine-kiềm và những ứng dụng quan trọng của chúng.
NaHCO3 dùng để tạo bọt và tăng pH trong các loại thuốc sủi bọt. Hãy tìm hiểu và giải thích.
Vì sao phương pháp Solvay được gọi là phương pháp tuần hoàn ammonia. Nêu những ưu điểm của phương pháp.
Hãy vẽ sơ đồ tổng hợp Na2CO3 theo phương pháp Solvay.
Phương pháp điều chế NaOH trong công nghiệp là
A. Cho kim loại Na tác dụng với nước.
B. Cho Na2O tác dụng với nước.
C. Điện phân dung dịch NaCl bão hoà có màng ngăn.
D. Điện phân dung dịch NaCl bão hoà, không có màng ngăn.
Viết phương trình hoá học của phản ứng khi cho potassium tác dụng với chlorine. Sản phẩm của phản ứng có tan tốt trong nước không? Tìm hiểu một số ứng dụng của nó.
Viết phương trình hoá học của phản ứng xảy ra trong các thí nghiệm sau:
a) Cho một mẩu kim loại sodium vào cốc nước.
b) Sục khí CO2 vào dung dịch KOH.
c) Nhỏ dung dịch HCl vào ống nghiệm có chứa sẵn Na2CO3.
d) Nhỏ dung dịch HCl vào ống nghiệm có chứa sẵn KHCO3.
e) Cho một lượng NaHCO3 rắn vào ống nghiệm rồi đun nóng trên ngọn lửa đèn cồn.
Hợp chất nào sau đây vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH?
-
A.
NaHCO3
-
B.
NaCl.
-
C.
Ba(OH)2.
-
D.
Na2CO3.
Những lĩnh vực nào sau đây ứng dụng nhiều kim loại nhóm IA và các hợp chất của chúng?
(a) xây dựng, công nghiệp ô tô, luyện kim. (b) sản xuất pháo hoa.
(c) sản xuất phân bón. (d) chế biến thực phẩm.
(e) pin, đồng hồ nguyên tử.
-
A.
(a), (b), (c), (d), (e)
-
B.
(a), (c), (d), (e)
-
C.
(b), (d), (e)
-
D.
(c), (e)
Độ hòa tan của NaHCO3 ở 20oC và 60oC lần lượt là 9,6 và 16,5 g/100 g H2O. Để 1 tấn dung dịch NaHCO3 bão hòa ở 60oC làm nguội về 20oC (giả thiết không có sự bay hơi của nước), thu được dung dịch X và a kg chất rắn khan. Giá trị của a là
-
A.
59,23.
-
B.
69,00.
-
C.
54,04.
-
D.
96,00.
Nhiệt tạo thành của một số chất được cho trong bảng sau:
|
Chất |
Na2CO3(s) |
NaHCO3(s) |
Na2O(s) |
CO2(g) |
H2O(l) |
|
\({\Delta _f}H_{298}^0\) (kJ.mol – 1) |
-1130,70 |
-950,81 |
-414,20 |
-393,51 |
-285,83 |
Một phát biểu sau đây là đúng hay sai?
Những phát biểu nào sau đây là không đúng?
(a) Quá trình hình thành muối NaHCO3 từ các đơn chất thuận lợi về năng lượng hơn so với quá trình hình thành muối Na2CO3 từ các đơn chất.
(b) Giá trị biến thiên enthalpy chuẩn bị của phản ứng
2NaHCO3(s) \( \to \) Na2CO3(s) + H2O(l) + CO2(g) là -91,28kJ.
(c) Phản ứng Na2CO3(s) \( \to \) Na2O(s) + CO2(g) không diễn ra ở điều kiện thường, phù hợp với giá trị biến thiên enthalpy chuẩn của phản ứng khá dương.
(d) Na2CO3 bền với nhiệt hơn NaHCO3.
Soda được sản xuất theo phương pháp Solxay theo các phương trình hóa học sau:
NaCl(aq) + CO2(g) + H2O(l) + NH3(aq) \( \to \) NaHCO3(s) + NH4Cl(aq) (1)
2NaHCO3(s) \( \to \) Na2CO3(s) + CO2(g) + H2O(g) (2)
2NH4Cl(aq) + CaO(s) \( \to \) 2NH3(g) + CaCl2(aq) + H2O(l) (3)
Những phát biểu nào sau đây là không đúng?
(a) Phản ứng (1) cho thấy H2CO3 (CO2 + H2O) có tính acid mạnh hơn dung dịch HCl.
(b) Muối sodium hydrogencarbonate ít tan trong nước và kém bền khi bị nung nóng.
(c) Phản ứng (3) nhằm thu hồi và tái sử dụng NH3.
(d) Trong phản ứng (2) khối lượng chất rắn giảm 45% sau khi nung (giả sử hiệu suất nung là 100%).
Những phát biểu nào sau đây là đúng?
(a) Soda là chất bột màu trắng, tan trong nước tạo môi trường trung tính.
(b) Soda có thể được dùng để làm mền nước cứng.
(c) Soda bền với nhiệt hơn so với baking soda.
(d) Chất béo có thể bị thủy phân trong dung dịch soda tạo thành xà phòng.
(e) Có thể dùng baking soda thay cho soda trong việc tẩy rửa lớp dầu, mỡ bám vào bồn rửa.
Những phát biểu nào sau đây là đúng về hợp chất sodium hydrogen carbonate?
(1) Còn gọi là sodium bicarbonate hay baking soda.
(2) Được dùng để điều trị chứng dư acid trong dạ dày, làm mềm thực phẩm
(3) Là chất dạng bột màu trắng, dễ bị oxi hóa bởi oxygen trong không khí.
A. (1) và (2) B. (1), (2) và (3) C. (1) và (3) D. (2)
Trong thực tế, trong quá trình điện phân dung dịch sodium chloride bão hòa, sau một thời gian, dung dịch NaCl tại anode được gọi là “nước muối nghèo” và được đưa ra khỏi bể điện phân; đồng thời dung dịch NaCl bão hòa mới được bổ sung vào để tiếp tục quá trình điện phần (như Hình 17.1). Hãy giải thích việc làm này, viết phương trình hóa học (nếu có). Biết rằng, dung dịch tại bể anode có pH = 3; \(E_{C{l_2}/2Cl - }^o\)= 1,36 V; \(E_{{O_2},4{H^ + }/2{H_2}O\;}^o\)= 1,23 V.
Nước muối bão hòa có nồng độ 300 g L–1 , trong khi đó “nước muối nghèo” có nồng độ 220 g L-1. Với mỗi lít nước muối bão hòa ban đầu thì thu được bao nhiêu gam sodium hydroxide, nếu hiệu suất của quá trình là 80%.
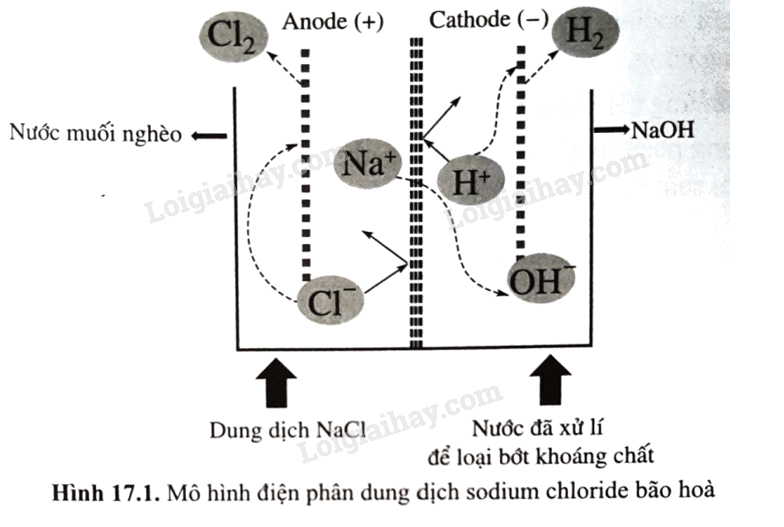
Công đoạn chính của công nghiệp chlorine – kiềm là điện phân dung dịch sodium chlorine bão hòa trong bể điện phân có màng ngăn xốp. Phương trình hóa học của quá trình điện là: 2NaCl + 2H2O \( \to \) 2NaOH + H2 + Cl2.
Mỗi phát biểu sau đây là đúng hay sai?
(a) Anion Cl – bị khử thành khí chlorine tại anode.
(b) Tại cathode, thu được đồng thời dung dịch bão hòa và tinh thể sodium hydroxide.
(c) Nếu không có màng ngăn xốp, nước Javel được hình thành trong bể điện phân.
(d) Hydrogen cũng là một sản phẩm có giá trị của công nghiệp chlorine – kiềm.
Viết phương trình hóa học của phản ứng xảy ra khi thực hiện phản ứng giữa sodium lần lượt với lượng dư chlorine, oxygen và lưu huỳnh. Giả sử sodium bị oxi hóa hết trong mỗi phản ứng.
Cho một lượng nước thích hợp vào mỗi sản phẩm thu được ở trên để thu được các dung dịch có nồng độ khoảng 0,1 M. Dự đoán pH của mỗi dung dịch thu được và giải thích.
Các kim loại kiềm có khối lượng riêng nhỏ và độ cứng thấp hơn nhiều so với các kim loại khác. Nguyên nhân là do:
(1) Tinh thể có kiểm mạng lập phương tâm khối.
(2) Khối lượng nguyên tử nhỏ hơn các kim loại khác.
(3) Có lực liên kết kim loại yếu.
A. (1), (2) và (3). B. (2) và (3).
C. (1) và (3). D. (1) và (3).
Giá trị biến thiên tạo thành chuẩn (kJ mol-1) của NaHCO3(s), Na2CO3(s), CO2(g) và H2O(g) lần lượt là -950,81; -1130,70; -393,51 và -241,8.
a) Tính giá trị biến thiên enthalpy chuẩn của phản ứng sau: 2NaHCO3(s)\( \to \) Na2CO3(s) + H2O(g) + CO2(g)
b) Phản ứng trên có thuận lợi về mặt năng lượng không?
c) Theo em, vì sao baking soda không bị phân hủy theo phản ứng ở ý a) khi được bảo quản ở nơi thoáng mát.







Danh sách bình luận