Viết các phương trình hóa học của các phản ứng sau (viết tên sản phẩm):
\(\begin{array}{l}{\rm{a) Li + }}{{\rm{O}}_2} \to \\{\rm{b) Na + C}}{{\rm{l}}_2} \to \\{\rm{c) K + B}}{{\rm{r}}_2} \to \end{array}\)
Kim loại nhóm IA có tính khử mạnh, tính khử tăng dần từ Li đến Cs.
\({\rm{M}} \to {{\rm{M}}^ + } + 1{\rm{e}}\)
Trong hợp chất, kim loại nhóm IA chỉ có số oxi hoá +1.
\(\begin{array}{l}{\rm{a) 2Li + }}{{\rm{O}}_2} \to {\rm{L}}{{\rm{i}}_{\rm{2}}}{\rm{O (lithium oxide)}}\\{\rm{b) 2Na + C}}{{\rm{l}}_2} \to {\rm{ 2NaCl (sodium chloride)}}\\{\rm{c) 2K + B}}{{\rm{r}}_2} \to {\rm{ 2KBr (potassium bromide)}}\end{array}\)

Các bài tập cùng chuyên đề
Phân biệt các ion Li+, Na+, K+ bằng màu ngọn lửa (học sinh quan sát video thí nghiệm)
- Hoá chất: các dung dịch bão hoà: LiCl, NaCl, KCl.
- Dụng cụ: ống nghiệm, giá ống nghiệm; dây platinum (hoặc nickel); đèn khi Bunsen (khí gas).
- Tiến hành:
+ Nhúng dây platinum vào ống nghiệm chứa dung dịch LiCl bão hoà.
+ Hơ nóng đầu dây trên ngọn lửa đèn khí.
+ Tiến hành thí nghiệm tương tự với dung dịch NaCl bão hoà và dung dịch KCl bão hoà.
- Quan sát hiện tượng xảy ra qua video thí nghiệm và thực hiện yêu cầu sau: Nhận xét về màu ngọn lửa các ion kim loại trong thí nghiệm.
a) Tại sao có thể bảo quản Na, K bằng cách ngâm trong dầu hoả?
b) Có thể sử dụng các alcohol (ví dụ ethanol) để bảo quản kim loại nhóm IA không? Giải thích.
Trong phòng thí nghiệm:
a) Khi cho kim loại nhóm IA (Li, Na, K) tác dụng với nước thì cần lấy mẫu kim loại nhỏ. Giải thích.
b) Sodium được dùng để loại nước khỏi một số dung môi hữu cơ như ether. Giải thích.
Thí nghiệm 3: Tác dụng với oxygen
- Tiến hành: Cho mỗi mẫu kim loại Li, Na, K vào một muối sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy rồi đưa nhanh vào lọ đựng khí oxygen.
- Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K.
- Thực hiện yêu cầu sau: Viết phương trình hoá học của các phản ứng xảy ra.
Thí nghiệm 2: Tác dụng với chlorine
- Tiến hành: Cho mỗi mẫu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy, rồi đưa nhanh vào bình đựng khí chlorine.
- Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K.
- Thực hiện yêu cầu sau: Viết phương trình hoá học của các phản ứng xảy ra.
- Tiến hành: Cho mỗi mẫu kim loại vào một chậu thuỷ tinh chứa nước, hiện tượng xảy ra được ghi lại ở Bảng 24.3.

- Thực hiện các yêu cầu sau:
1. So sánh mức độ phản ứng của Li, Na, K với nước.
2. Viết phương trình hoá học của các phản ứng xảy ra. Nêu cách nhận biết môi trường của các dung dịch sau phản ứng.
Dự đoán potassium hay lithium phản ứng với nước mạnh hơn.
Thí nghiệm 1: Tác dụng với nước
Dùng panh lấy mẩu kim loại (Li, Na hoặc K) cho vào chậu thủy tinh chứa khoảng 1/3 thể tích nước. Thêm vài giọt dung dịch phenolphthalein vào chậu sau khi kim loại tan hết.
Yêu cầu: Nêu các hiện tượng và so sánh mức độ phản ứng.
Thí nghiệm 2: Tác dụng với oxygen
Dùng panh lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hóa chất (muỗng được xuyên qua một nút cao su). Đốt kim loại trong muỗng trên ngọn lửa đèn cồn và đưa nhanh vào bình tam giác chịu nhiệt chứa khí oxygen. Đậy nhanh nút cao su gắn với muỗng vào miếng bình tam giác.
Yêu cầu: Quan sát hiện tượng thí nghiệm.
Thí nghiệm: Tác dụng với chlorine
Dùng panh lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hóa chất (muỗng được xuyên qua một nút cao su). Đốt kim loại trong muỗng trên ngọn lửa đèn cồn rồi đưa nhanh vào bình tam giác chịu nhiệt chứa khí chlorine. Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác
Yêu cầu: Quan sát hiện tượng thí nghiệm.
Viết phương trình hóa học của phản ứng giữa Na lần lượt với H2O, Cl2 và O2.
Nhúng đầu dây platium vào dung dịch hydroxide của một kim loại kiềm; sau đó, đưa đầu dây platinum vào ngọn lửa đèn khí thì có hiện tượng như hình dưới đây. Hãy cho biết dây platinum đã được nhúng vào dung dịch nào sau đây LiOH, NaOH, KOH.
Vì sao trong tự nhiên không tìm thấy đơn chất kim loại kiềm?
Có ba ống nghiệm chứa riêng biệt: dung dịch soda, dung dịch lithium chloride, dung dịch potassium carbonate. Với mỗi dung dịch, nhúng đầu dây platinum vào rồi đem đốt trên ngọn lửa đèn khí. Dự đoán hiện tượng xảy ra khi đốt mỗi dung dịch.
Dựa vào cấu hình electron nguyên tử và giá trị thế điện cực chuẩn, dự đoán tính chất hoá học đặc trưng của kim loại nhóm IA.
Khi cắt mẩu sodium ở trong không khí, bề mặt vừa cắt có ánh kim lập tức mờ đi. Giải thích. Hãy dự đoán hiện tượng xảy ra khi cắt kim loại lithium, potassium trong không khí.
Tại sao để bảo quản kim loại Na, K người ta ngâm chúng trong dầu hoả? Li có dùng cách này được không? Giải thích.
Kim loại nhóm IA hoạt động hóa học mạnh. Tại sao?
Kim loại nhóm IA phản ứng dễ dàng với oxygen và nước, mức độ mãnh liệt của phản ứng tăng dần từ Li đến K. Giải thích.
Quan sát thí nghiệm thử màu ngọn lửa, nêu hiện tượng quan sát được. Rút ra kết luận.
Khi tham gia phản ứng hóa học, mỗi nguyên tử kim loại nhóm IA đều thể hiện khuynh hướng
-
A.
Nhường 2 electron.
-
B.
Nhận 2 electron.
-
C.
Nhận 1 electron.
-
D.
Nhường 1 electron.
Công thức chung của oxide kim loại nguyên tố nhóm IA là
-
A.
R2O3
-
B.
RO2
-
C.
R2O
-
D.
RO
Thực hiện các thí nghiệm sau:
(I) Cho dd NaCl vào dd KOH. (II) Cho dd Na2CO3 vào dd Ca(OH)2.
(III) Cho Cu(OH)2 vào dd NaNO3. (IV) Điện phân dd NaCl với điện cực trơ, có màng ngăn.
(V) Sục khí NH3 vào dd Na2CO3. (VI) Cho dd Na2SO4 vào dd Ba(OH)2.
Các thí nghiệm đều điều chế được NaOH là
-
A.
II, IV và VI
-
B.
I, II và III
-
C.
II, V và VI
-
D.
I, IV và V
Cho 1,9 gam hỗn hợp gồm muối carbonate và hydrocarbonate của một kim loại kiềm. Tác dụng với dung dịch HCl dư thu được 0,496 lít khí (đkc). Kim loại kiềm là
-
A.
K
-
B.
Li.
-
C.
Na.
-
D.
Rb.
Hòa tan hoàn toàn hỗn hợp K và Na vào nước, thu được dung dịch X và a mol khí H2. Trung hòa X cần 200 mL dung dịch H2SO4 0,1 M. Giá trị của a là
-
A.
0,04.
-
B.
0,02.
-
C.
0,005.
-
D.
0,01.
Nhúng queo platinum sạch vào dung dịch chất X, sau đó đưa lên ngọn lửa đèn khí, đèn khí cháy với ngọn lửa màu vàng. Mặt khác, thêm vài giọt dung dịch chất X vào dung dịch silver nitrate thất xuất hiện kết tủa vàng. X có thể là chất nào sau đây?
(1) Potassium iodide. (2) Sodium iodide.
(3) Sodium phosphate. (4) Potassium phosphate.
-
A.
(1) hoặc (4).
-
B.
(2) hoặc (3).
-
C.
(2).
-
D.
(3) hoặc (4).
Cho dãy chuyển hoá sau:
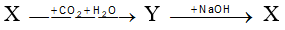
Công thức của X là
-
A.
NaHCO3.
-
B.
Na2O.
-
C.
NaOH.
-
D.
Na2CO3.
Nhúng queo platinum sạch vào dung dịch chất X, sau đó đưa lên ngọn lửa đèn khí, đèn khí cháy với ngọn lửa màu vàng. Mặt khác, thêm vài giọt dung dịch chất X vào dung dịch silver nitrate thất xuất hiện kết tủa vàng. X có thể là chất nào sau đây?
(1) Potassium iodide. (2) Sodium iodide.
(3) Sodium phosphate. (4) Potassium phosphate.
A. (1) hoặc (4). B. (2) hoặc (3).
C. (2). D. (3) hoặc (4).
Trong các phản ứng sau đây, phản ứng nào diễn ra mãnh liệt nhất?
A. Lithium và bromine.
B. Potassium và chlorine
C. Lithium và chlorine.
D. Sodium và bromine.
Dùng panh lấy các mẫu kim loại (Li, Na hoặc K) có kích cỡ xấp xỉ nhau đã thấm khô dầu và cho vào các chậu thủy tinh đã chứa khoảng 1/3 thể tích nước. Thêm 2 – 3 giọt dung dịch phenolphthalein vào chậu sau khi kim loại tan hết.
Mỗi phát biểu sau đây là đúng hay sai?
(a) Các dung dịch thu được sau phản ứng đề có màu hồng.
(b) Trong nước, potassium tan nhanh hơn so với sodium, sodium tan nhanh hơn so với lithium.
(c) Các cặp oxi hóa – khử M+/M (M: Li, Na, K) đều có giá trị thế điện cực chuẩn lớn hơn giá trị thế điện cực chuẩn của cặp oxi hóa – khử 2H2O/H2 + 2OH–.
(d) Kết quả thí nghiệm cho kết luận tính khử của các kim loại tăng dần theo dãy K, Na, Li.







Danh sách bình luận