Một bình gas (khí hóa lỏng) chứa hỗn hợp propane và butane với tỉ lệ mol 1:2. Xác định nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 12 kg khí gas trên ở điều kiện chuẩn.
Cho biết các phản ứng: 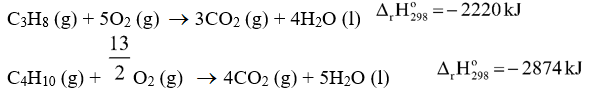
Trung bình mỗi ngày, một hộ gia đình cần đốt gas để cung cấp 10000 kJ nhiệt (hiệu suất hấp thụ nhiệt là 80%). Sau bao nhiêu ngày hộ gia đình trên sẽ sử dụng hết bình gas 12 kg?
Gọi số mol của propane là a mol => n butane = 2a mol
Khối lượng của khí gas = m C3H8 + m C4H10 = a.44 + 2a.58 = 12.103
=> a = 75 mol
Lượng nhiệt tỏa ra khi đốt khí gas là: 75.2220 + 150.2874 = 597600 kJ
Số ngày hộ gia đình trên sử dụng hết bình gas 12kg là: \(\frac{{597600}}{{10000}}.80\% \approx 48\)ngày
Các bài toán tính tổng nhiệt lượng của các chất thì cần phải tìm số mol thành phần trong hỗn hợp. Sau đó lấy số mol đã tính được nhân với nhiệt lượng của từng chất khi cháy.
- Nhiệt lượng (Q) tỏa ra khi đốt cháy một chất: Qtỏa = số mol x lượng nhiệt tỏa ra khi đốt cháy 1 mol chất
- Nhiên liệu thường là hỗn hợp các chất nên lượng nhiệt tỏa ra khi đốt cháy nhiên liệu bằng tổng lượng nhiệt đốt cháy các chất thành phần: Qtổng = Q1 + Q2 + ….
- Các quá trình sử dụng nhiệt thường bị thất thoát nhiệt ra môi trường nên hiệu suất sử dụng nhiệt < 100%
- Nhiệt lượng vật tỏa ra hoặc thu vào: Q = m.c.ΔT
+ m: Khối lượng chất (với dung dịch loãng coi khối lượng riêng là khối lượng riêng của nước: 1g/ml)
+ c: Nhiệt dung (năng lượng cần để đưa 1 gam chất tăng lên 1oC).
Với dung dịch loãng coi nhiệt dung của dung dịch là nhiệt dung của nước: c = 4,2 J/g.K
+ ΔT là độ biến thiên nhiệt độ (|t2 – t1|)








Danh sách bình luận