Cho: ZMg = 12, ZAl = 13, ZCl = 17, ZF = 9. Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là
-
A.
Al > Mg > F > Cl.
-
B.
Al > Mg > Cl > F.
-
C.
Mg > Al > Cl > F.
-
D.
Mg > Al > F > Cl.
- Xác định vị trí tương đối của các nguyên tố trong BTH các nguyên tố hóa học.
- So sánh bán kính:
+ Nguyên tử nguyên tố nào có số lớp e lớn hơn thì bán kính lớn hơn.
+ Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần.
+ Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần.
ZMg = 12: 1s2 2s2 2p6 3s2 → chu kì 3, nhóm IIA
ZAl = 13: 1s2 2s2 2p6 3s2 3p1 → chu kì 3, nhóm IIIA
ZCl = 17: 1s2 2s2 2p6 3s2 3p5 → chu kì 3, nhóm VIIA
ZF = 9: 1s2 2s2 2p5 → chu kì 2, nhóm VIIA
Vị trí tương đối của các nguyên tố trong BTH:
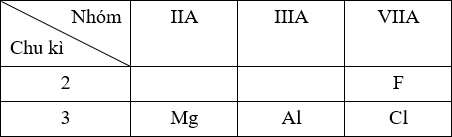
⟹ Bán kính: Mg > Al > Cl > F.
Đáp án : C








Danh sách bình luận