Nước trong tự nhiên được phân loại thành nước cứng hoặc nước mềm tùy thuộc vào loại và lượng khoáng và muối tự nhiên hòa tan trong đó. Nước cứng có hàm lượng các chất khoáng hòa tan tương đối cao đến rất cao trong khi nước mềm có hàm lượng hòa tan thấp.
Nước cứng là loại nước tự nhiên chứa trên 3 mili đương lượng gam cation canxi (Ca2+) và magie (Mg2+) trong một lít nước. Nước chứa nhiều Mg2+ có vị đắng. Tổng hàm lượng ion Ca2+ và Mg2+ đặc trưng cho tính chất cứng của nước. Độ cứng của nước thiên nhiên dao động rất nhiều và đặc trưng ở nước ngầm.
Hai loại độ cứng phổ biến trong nước là độ cứng tạm thời và độ cứng vĩnh cửu. Độ cứng tạm thời của nước có thể loại trừ bằng việc bổ sung vôi hoặc bằng cách đun sôi, trong khi đó không thể loại bỏ độ cứng vĩnh cửu của nước bằng cách đun sôi, chúng có xu hướng hòa tan hơn khi nhiệt độ tăng và chỉ có thể loại bỏ bằng cách sử dụng hóa chất hoặc các thiết bị khác.
Nước trong tự nhiên được phân loại thành nước cứng hoặc nước mềm tùy thuộc vào loại và lượng khoáng và muối tự nhiên hòa tan trong đó. Nước cứng có hàm lượng các chất khoáng hòa tan tương đối cao đến rất cao trong khi nước mềm có hàm lượng hòa tan thấp.
Nước cứng là loại nước tự nhiên chứa trên 3 mili đương lượng gam cation canxi (Ca2+) và magie (Mg2+) trong một lít nước. Nước chứa nhiều Mg2+ có vị đắng. Tổng hàm lượng ion Ca2+ và Mg2+ đặc trưng cho tính chất cứng của nước. Độ cứng của nước thiên nhiên dao động rất nhiều và đặc trưng ở nước ngầm.
Hai loại độ cứng phổ biến trong nước là độ cứng tạm thời và độ cứng vĩnh cửu. Độ cứng tạm thời của nước có thể loại trừ bằng việc bổ sung vôi hoặc bằng cách đun sôi, trong khi đó không thể loại bỏ độ cứng vĩnh cửu của nước bằng cách đun sôi, chúng có xu hướng hòa tan hơn khi nhiệt độ tăng và chỉ có thể loại bỏ bằng cách sử dụng hóa chất hoặc các thiết bị khác.
Một loại mẫu nước cứng có chứa các ion Ca2+, Mg2+, HCO3-, Cl-, SO42-. Chất được dùng để làm mềm mẫu nước cứng trên là
Một loại mẫu nước cứng có chứa các ion Ca2+, Mg2+, HCO3-, Cl-, SO42-. Chất được dùng để làm mềm mẫu nước cứng trên là
Đáp án: C
Để làm mềm mẫu nước cứng trên ta có thể dùng Na3PO4 vì PO43- kết tủa hết Ca2+ và Mg2+:
3Ca2+ + 2PO43- → Ca3(PO4)2 ↓
3Mg2+ + 2PO43- → Mg3(PO4)2 ↓

Trong một cốc nước có chứa 0,01 mol K+, 0,02 mol Ca2+; 0,01 mol Mg2+; 0,05 mol HCO3- và anion X-. Đun nóng cốc đến khối lượng không đổi thu được 3,64 gam chất rắn. Nước trong cốc thuộc loại
Trong một cốc nước có chứa 0,01 mol K+, 0,02 mol Ca2+; 0,01 mol Mg2+; 0,05 mol HCO3- và anion X-. Đun nóng cốc đến khối lượng không đổi thu được 3,64 gam chất rắn. Nước trong cốc thuộc loại
Đáp án: D
- Áp dụng định luật bảo toàn điện tích ⟹ số mol anion X-.
- Sau khi đun nóng cốc nước ⟹ Thành phần chất rắn ⟹ Anion X-
- Trong một cốc nước có chứa 0,01 mol K+, 0,02 mol Ca2+; 0,01 mol Mg2+; 0,05 mol HCO3- và anion X-.
- Áp dụng định luật bảo toàn điện tích ⟹ nX- = 0,01.1 + 0,02.2 + 0,01.2 – 0,05.1 = 0,02 mol.
- Xét khi đun nóng cốc nước:
Theo PTHH: 2HCO3-\(\xrightarrow{{{t^0}}}\) CO32- + CO2 ↑ + H2O
⟹ \({n_{C{O_3}^{2 - }}} = \dfrac{{{n_{HC{O_3}^ - }}}}{2} = 0,025(mol)\)
- Sau đun nóng đến khối lượng không đổi trong cốc còn lại các ion 0,01 mol K+, 0,02 mol Ca2+; 0,01 mol Mg2+; 0,025 mol CO32- và 0,02 mol X-.
Ta có: mc/rắn = 0,01.39 + 0,02.40 + 0,01.24 + 0,025.60 + 0,02.MX = 3,64 ⟹ MX = 35,5 (anion là Cl-).
Vậy nước trong cốc chứa các ion Ca2+, Mg2+, Cl- thuộc loại nước cứng toàn phần.
Trong một bể nước gia đình, người ta xử lí nước cứng vĩnh cửu bằng cách cho Ca(OH)2 vào bể nước. Biết rằng khi trích mẫu thử nghiên cứu thì người ta phân tích được trong nước có nồng độ các ion Ca2+ 0,004M; Mg2+ 0,003M và HCO3-. Thể tích dung dịch Ca(OH)2 0,02M vừa đủ để xử lí bể nước có thể tích 1000 lít nước cứng thành nước mềm là V lít. Coi như các phản ứng xảy ra hoàn toàn và kết tủa thu được gồm CaCO3 và Mg(OH)2. Giá trị của V là
Trong một bể nước gia đình, người ta xử lí nước cứng vĩnh cửu bằng cách cho Ca(OH)2 vào bể nước. Biết rằng khi trích mẫu thử nghiên cứu thì người ta phân tích được trong nước có nồng độ các ion Ca2+ 0,004M; Mg2+ 0,003M và HCO3-. Thể tích dung dịch Ca(OH)2 0,02M vừa đủ để xử lí bể nước có thể tích 1000 lít nước cứng thành nước mềm là V lít. Coi như các phản ứng xảy ra hoàn toàn và kết tủa thu được gồm CaCO3 và Mg(OH)2. Giá trị của V là
Đáp án: A
- Xét 1 lít nước cứng cần xử lí ⟹ số mol Ca2+ và Mg2+ trong nước cứng.
- Giả sử số mol Ca(OH)2 cần dùng vừa đủ để xử lí 1 lít nước cứng là x (mol).
- Xét 1 lít nước cứng cần xử lí ta có: nCa2+ = 0,004 mol và nMg2+ = 0,003 mol.
- Giả sử số mol Ca(OH)2 cần dùng vừa đủ để xử lí 1 lít nước cứng là x (mol).
Ta có: \({n_{C{a^{2 + }}}} = x + 0,004;{n_{O{H^ - }}} = 2x;{n_{M{g^{2 + }}}} = 0,003\)
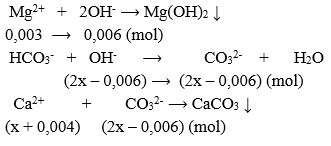
- Lượng Ca(OH)2 cần dùng vừa đủ
⟹ \({n_{C{a^{2 + }}}} = {n_{C{O_3}^{2 - }}} \Rightarrow x + 0,004 = 2x - 0,006 \Rightarrow x = 0,01(mol)\)
- Ta có thể tích dung dịch Ca(OH)2 cần dùng vừa đủ để xử lí 1 lít nước cứng là V(1) = 0,01/0,02 = 0,5 lít.
Vậy thể tích dung dịch Ca(OH)2 cần dùng vừa đủ để xử lí 1000 lít nước cứng là V = 0,5.1000 = 500 lít.








Danh sách bình luận