Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
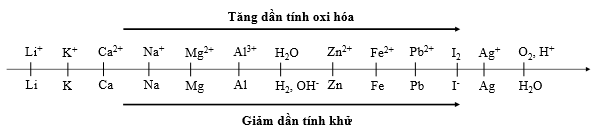
Cho dãy điện hóa sau:
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch NaCl bão hòa bằng hệ điện phân sử dụng các điện cực than chì và có màng ngăn xốp. Sau một thời gian bạn sinh viên ngắt dòng điện và thu được dung dịch X.
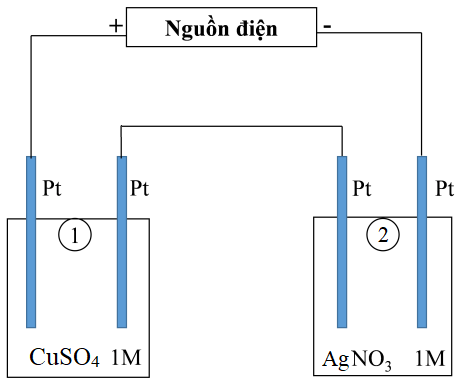
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
- Bình (1) chứa 100 ml dung dịch CuSO4 1M.
- Bình (2) chứa 100 ml dung dịch AgNO3 1M.
Sau thời gian t giây, sinh viên quan sát thấy ở bình (2) bắt đầu xuất hiện khí. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Cu và Ag lần lượt là 64 và 108 đvC.
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:

Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch NaCl bão hòa bằng hệ điện phân sử dụng các điện cực than chì và có màng ngăn xốp. Sau một thời gian bạn sinh viên ngắt dòng điện và thu được dung dịch X.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
- Bình (1) chứa 100 ml dung dịch CuSO4 1M.
- Bình (2) chứa 100 ml dung dịch AgNO3 1M.
Sau thời gian t giây, sinh viên quan sát thấy ở bình (2) bắt đầu xuất hiện khí. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Cu và Ag lần lượt là 64 và 108 đvC.

Trong thí nghiệm 1, bán phản ứng xảy ra tại catot là
Trong thí nghiệm 1, bán phản ứng xảy ra tại catot là
Đáp án: C
Catot của thiết bị là nơi xảy ra bán phản ứng khử.
Khi điện phân dung dịch, tại catot ion Na+ không bị điện phân nên xảy ra sự điện phân H2O.
Bán phản ứng xảy ra tại catot là 2H2O + 2e → H2 + 2OH-.

Trong thí nghiệm 1, phát biểu nào sau đây đúng khi nói về dung dịch X?
Trong thí nghiệm 1, phát biểu nào sau đây đúng khi nói về dung dịch X?
Đáp án: B
Bước 1: Viết các quá trình điện phân ở hai cực của thiết bị.
Bước 2: Đánh giá môi trường của dung dịch sau điện phân.
Bước 1: Viết các quá trình điện phân ở hai cực của thiết bị.
Bán phản ứng xảy ra trên mỗi điện cực:
+ Tại catot (-): 2H2O + 2e → 2OH- + H2
+ Tại anot (+): 2Cl- → Cl2 + 2e
Bước 2: Đánh giá môi trường của dung dịch sau điện phân.
Do đó dung dịch thu được có môi trường kiềm nên làm phenolphtalein chuyển sang màu hồng.
Trong thí nghiệm 2, số gam kim loại Cu bám lên điện cực trong bình (1) tại thời điểm t giây là
Trong thí nghiệm 2, số gam kim loại Cu bám lên điện cực trong bình (1) tại thời điểm t giây là
Đáp án: A
Bước 1: Tính số mol e trao đổi của bình 1
- Khi bắt đầu xuất hiện khí ở catot tức là H2O vừa điện phân tại catot thì ta dừng lại nên coi như Ag+ bị điện phân vừa hết và H2O chưa bị điện phân.
- Viết bán phản ứng điện phân tại catot. Từ số mol Ag+ tính được số mol e trao đổi của bình (2).
- Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau nên ⟹ ne (bình 1) = ne (bình 2).
Bước 2: Tính khối lượng Cu thu được
- So sánh \({n_{e(binh\,1)}} và 2{n_{C{u^{2 + }}}}\)
+ Nếu \({n_{e(binh\,1)}} < 2{n_{C{u^{2 + }}}}\) thì Cu2+ chưa bị điện phân hết
+ Nếu \({n_{e(binh\,1)}} = 2{n_{C{u^{2 + }}}}\) thì Cu2+ đã điện phân hết
Bước 1: Tính số mol e trao đổi của bình 1
- Khi bắt đầu xuất hiện khí ở catot tức là H2O vừa điện phân tại catot thì ta dừng lại nên coi như Ag+ bị điện phân vừa hết và H2O chưa bị điện phân.
\({n_{AgN{O_3}}} = 0,1.1 = 0,1\left( {mol} \right)\)
- Tại catot (-) của bình 2:
Ag+ + 1e → Ag
0,1 → 0,1 (mol)
⟹ ne (bình 2) = 0,1 mol.
Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau nên ⟹ ne (bình 1) = ne (bình 2) = 0,1 mol.
Bước 3: Tính khối lượng Cu thu được
- Bình (1): \({n_{CuS{O_4}}} = 0,1.1 = 0,1\left( {mol} \right)\)
- Ta thấy: \({n_{e(binh\,1)}} < 2{n_{C{u^{2 + }}}}\) nên Cu2+ chưa bị điện phân hết
Tại catot (-): Cu2+ + 2e → Cu
0,1 → 0,05 (mol)
- Khối lượng Cu bám lên điện cực trong bình (1) là mCu = 0,05.64 = 3,2 (g)








Danh sách bình luận