Đọc ngữ cảnh dưới đây và trả lời 3 câu hỏi sau:
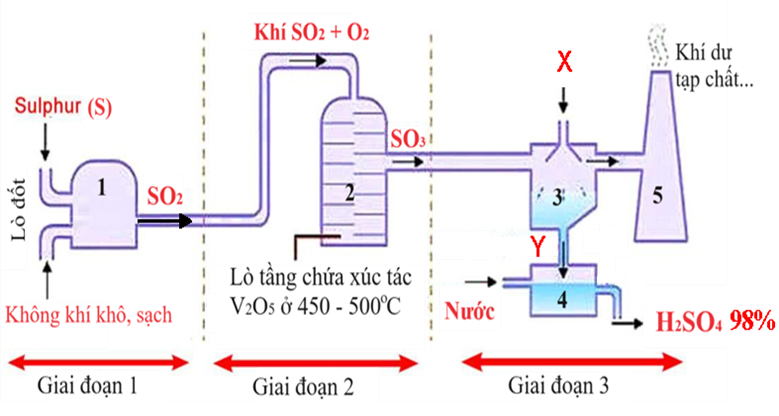
Sulfuric acid (H2SO4) là hợp chất quan trọng trong công nghiệp hóa chất, được sử dụng nhiều trong sản xuất phân bón, khai khoáng, chế biến dầu mỏ… Trong công nghiệp, sulfuric acid 98% được sản xuất từ sulfur theo quy trình tiếp xúc, sử dụng thiết bị phản ứng dòng liên tục, mô tả trong hình dưới đây.
Đọc ngữ cảnh dưới đây và trả lời 3 câu hỏi sau:
Sulfuric acid (H2SO4) là hợp chất quan trọng trong công nghiệp hóa chất, được sử dụng nhiều trong sản xuất phân bón, khai khoáng, chế biến dầu mỏ… Trong công nghiệp, sulfuric acid 98% được sản xuất từ sulfur theo quy trình tiếp xúc, sử dụng thiết bị phản ứng dòng liên tục, mô tả trong hình dưới đây.

Dòng hỗn hợp khí (gồm 80,3% N2, 11,5% O2, còn lại SO2 theo thể tích) ở 427 oC và 1,0 atm được dẫn vào lò phản ứng 2 (thiết bị số 2) với tốc độ v (m3/giờ). Biết rằng hiệu suất phản ứng tạo thành sulfur trioxide ở lò phản ứng 2 là 80% và nước được dẫn vào thiết bị số 4 với tốc độ 0,144 m3/giờ. Hãy tính tốc độ dòng hỗn hợp khí v (theo m3/giờ) cần dẫn vào thiết bị số 2 để thu được H2SO4 98% ở thiết bị số 4. Giả thiết các khí là khí lý tưởng. Hằng số khí R = 0,082 lít.atm/mol.K, khối lượng riêng của nước d = 1,0 g/cm3, khối lượng nguyên tử H: 1; O: 16, S: 32.
Dòng hỗn hợp khí (gồm 80,3% N2, 11,5% O2, còn lại SO2 theo thể tích) ở 427 oC và 1,0 atm được dẫn vào lò phản ứng 2 (thiết bị số 2) với tốc độ v (m3/giờ). Biết rằng hiệu suất phản ứng tạo thành sulfur trioxide ở lò phản ứng 2 là 80% và nước được dẫn vào thiết bị số 4 với tốc độ 0,144 m3/giờ. Hãy tính tốc độ dòng hỗn hợp khí v (theo m3/giờ) cần dẫn vào thiết bị số 2 để thu được H2SO4 98% ở thiết bị số 4. Giả thiết các khí là khí lý tưởng. Hằng số khí R = 0,082 lít.atm/mol.K, khối lượng riêng của nước d = 1,0 g/cm3, khối lượng nguyên tử H: 1; O: 16, S: 32.
574,0.
6424,6.
6770,4.
7000,0.
Đáp án: D
Dựa vào lí thuyết về điều chế H2SO4.
Sơ đồ phản ứng các giai đoạn điều chế H2SO4 98%
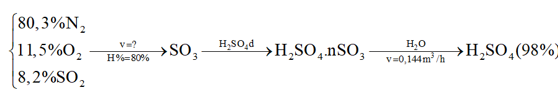
- Ở thiết bị số 4 ta tính được: 1 giờ có 0,144m3 H2O được dẫn vào.
→ m H2O = d.v = 1.106.0,144 = 144000g
→ n H2O = \(\frac{{144000}}{{18}} = 8000mol\)
Phương trình phản ứng:
2SO2 + O2 → 2SO3 (1)
\(nS{O_3} + {H_2}{\rm{S}}{O_4} \to {H_2}S{{\rm{O}}_4}.nS{O_3}\)(2)
8000 \( \leftarrow \) \(\frac{{8000}}{n}\)
\({H_2}{\rm{S}}{O_4}.nS{O_3} + n{H_2}{\rm{O}} \to (n + 1){H_2}{\rm{S}}{O_4}\)(3)
\(\frac{{8000}}{n}\) ← 8000
Phản ứng (1) vì H% = 80% nên n SO2 = \(\frac{{8000}}{{80\% }} = 10000mol\)
n hỗn hợp khí là: \(\frac{{10000.100}}{{8,2}}\)mol
V hỗn hợp khí = \(\frac{{nRT}}{P} = \frac{{\frac{{10000.100}}{{8,2}}.0,082.700}}{1} = 700000d{m^3} = 7000{m^3}\)
Đáp án: D

Số oxi hóa của sulfur thay đổi từ:
Số oxi hóa của sulfur thay đổi từ:
0 lên +2 ở giai đoạn 1.
0 lên +4 ở giai đoạn
+2 lên +4 ở giai đoạn 2.
+2 lên +6 ở giai đoạn 2.
Đáp án: B
Dựa vào lí thuyết về phản ứng oxi hoá khử.
Số oxi hóa của sulfur thay đổi
- Từ 0 lên +4 ở giai đoạn 1.
- Từ +4 lên +6 ở giai đoạn 2.
Đáp án: B
Trong giai đoạn 3, hóa chất X được thêm vào bình phản ứng 3 và thu được sản phẩm Y, trong đó X và Y lần lượt là:
Trong giai đoạn 3, hóa chất X được thêm vào bình phản ứng 3 và thu được sản phẩm Y, trong đó X và Y lần lượt là:
H2SO4 đặc và oleum.
H2O và H2SO4 loãng.
H2O và oleum.
H2SO4 loãng và H2SO4 98%.
Đáp án: A
Dựa vào lí thuyết về điều chế H2SO4.
X và Y lần lượt là H2SO4 đặc và oleum.
Đáp án: A

Các bài tập cùng chuyên đề
Sưu tầm tài liệu và trình bày về các ứng dụng của sulfuric acid trong các ngành sản xuất và đời sống. Vì sao sulfuric acid là hóa chất có tầm quan trọng bậc nhất?
Hãy cho biết giai đoạn nào trong quá trình sản xuất H2SO4 có nguy cơ cao gây ô nhiễm môi trường. Giải thích.
Quá trình sản xuất sulfuric acid có thể ảnh hưởng đến môi trường và người tham gia sản xuất. Hãy tìm hiểu nguyên nhân và đề xuất một số biện pháp hạn chế những tác hại đó.
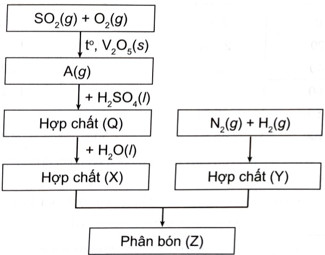
Sơ đồ quy trình dưới đây mô tả các bước trong quá trình sản xuất phân bón (Z). Hãy xác định các chất (A), (Q), (X), (Y), (Z). Viết các phản ứng hoá học xảy ra.
Sulfuric acid là hoá chất hàng đầu trong nhiều ngành sản xuất, được mệnh danh là “máu” của các ngành công nghiệp. Trong công nghiệp, sulfuric acid được sản xuất bằng phương pháp tiếp xúc. Phương pháp này gồm 3 công đoạn chính: sản xuất SO2 → sản xuất SO3 → sản xuất H2SO4. Trong công đoạn sản xuất SO3 từ SO2 để thực hiện cần có điều kiện phản ứng thích hợp. Hãy cho biết điều kiện của phản ứng trên là gì? Biết rằng trong tự nhiên cũng có một lượng sulfuric acid sinh ra theo các công đoạn trên. Hãy giải thích quá trình hình thành.
Nhiều hộ gia đình thường trữ một số hoá chất như baking soda (NaHCO3), thạch cao nung (CaSO4.0,5H2O) và phèn chua (hay phèn nhôm kali, K2SO4.Al2(SO4)3.24H2O hay KAl(SO4)2 12H2O).
a) Hãy tìm hiểu các ứng dụng của mỗi hoá chất trên tại các hộ gia đình.
b) Có thể dùng nước để phân biệt các mẫu bột mịn của ba chất trên không? Giải thích.
c) Có thể dùng nước và quỳ tím để phân biệt các mẫu bột mịn của ba chất trên không? Giải thích.
Cho các nguyên liệu sau: sulfur, quặng pyrite (FeS2), không khí, nước, vanadium(V) oxide (V2O5).
Số nguyên liệu được sử dụng trong công nghiệp sản xuất sulfuric acid là
A. 4. B. 2. C. 5. D. 3.
Trong công nghiệp sản xuất sulfuric acid, sulfur trioxide được hấp thụ vào dung dịch sulfuric acid đặc tạo thành những hợp chất có công thức chung là
A. H2S2O7. B. H2SO4. C. H2SO4.nSO3. D. (SO3)n.


Trong công nghiệp sản xuất sulfuric acid, hai nguồn nguyên liệu được khai thác từ mỏ để cung cấp nguyên tố lưu huỳnh là
A. ZnS, PbS. B. H2S, SO2.
C. CaSO4, BaSO4. D. S, FeS2.
Một nhà máy luyện kim, ở giai đoạn đầu của quá trình sản xuất Zn từ quặng blend thu được sản phẩm phụ là SO2 theo sơ đồ phản ứng: \({\rm{ZnS}} + {{\rm{O}}_{\rm{2}}} \to {\rm{ZnO}} + {\rm{S}}{{\rm{O}}_{\rm{2}}}\)
Đốt cháy 1 tấn quặng blend (chứa 77,6% khối lượng ZnS) bằng không khí, thu được tối đa V m3 khí SO2 (đkc). Giá trị của V là
A. 99,2. B. 198,3. C. 297,5. D. 396,6.
Trong công nghiệp, quặng pyrite sắt (FeS2) được dùng làm nguyên liệu để
A. luyện gang. B. sản xuất sulfuric acid.
C. chế tạo nam châm điện. D. tổng hợp dược phẩm.






