Bài 1. Liên kết hóa học - Chuyên đề học tập Hóa 10 Kết nối tri thức
Mở đầu: Theo em, dạng hình học nào sau đây của hai phân tử carbon dioxide và nước là đúng? Những electron như thế nào được gọi là: Electron hóa trị
Mở đầu
Dạng hình học phân tử ảnh hưởng đến khả năng phản ứng, hoạt tính sinh học, tính phân cực,… của phân tử. Dựa trên cơ sở nào để dự đoán dạng hình học của một phân tử
Phương pháp giải:
Mô hình VSEPR
Lời giải chi tiết:
Mô hình VSEPR được sử dụng để mô tả dạng hình học của các phân tử dựa trên lực đẩy giữa các cặp electron hóa trị
Tuy nhiên, do cặp electron chưa liên kết chiếm khoảng không gian lớn hơn so với các cặp electron liên kết, tương tác đẩy giữa các cặp electron chưa liên kết lớn hơn tương tác đẩy giữa các cặp electron liên kết, nên góc liên kết \[\widehat {HOH}\] thực tế bằng 104,5o, nhỏ hơn góc hóa trị theo lí thuyết (109,5o). Phân tử có dạng góc.
CH mục I CH1
Công thức Lewis của CS2 là
Phương pháp giải:
Bước 1: Xác định tổng electron hóa trị trong phân tử CS2
Bước 2: Vẽ khung phân tử
Bước 3: Điền các electron hóa trị chưa tham gia liên kết vào các nguyên tử xung quanh
Bước 4: Tính số electron hóa trị còn lại
Lời giải chi tiết:
Bước 1: C có 4 electron hóa trị, S có 6 electron hóa trị
=> Tổng electron hóa trị CS2 = 4 + 6.2 = 16 electron
Bước 2: Vẽ khung phân tử với các liên kết đơn
S – C – S
Bước 3: Mỗi nguyên tử S cần 6 electron hóa trị để đạt octet:
Bước 4:
- Số electron hóa trị còn lại = 16 – 2.2 – 6.2 = 0
- Số electron hóa trị của nguyên tử C là 4
=> Để đạt octet mỗi nguyên tử S dùng 1 cặp electron hóa trị để tạo liên kết đôi với nguyên tử C
Công thức Lewis của CS2:
Đáp án B
a) Electron hóa trị là những electron ở các orbital của lớp ngoài cùng và phân lớp sát ngoài cùng chưa bão hòa, có thể tham gia vào việc hình thành liên kết hóa học.
b) Electron chung là những electron hóa trị mà tham gia vào việc hình thành liên kết hóa học.
c) Electron hóa trị riêng là những electron hóa trị nhưng không tham gia vào việc hình thành liên kết hóa học.
Ví dụ:
- Nguyên tử Cl có có cấu hình electron là 1s22s22p63s23p5
⇒ Nguyên tử Cl có 7 electron hóa trị
- Phân tử Cl2 có liên kết giữa hai nguyên tử Cl được thực hiện nhờ 1 đôi electron góp chung; các
CH mục I CH2
Trình bày các bước để viết công thức Lewis của phân tử NH3
Công thức cấu tạo của CO2 là O = C = O
Công thức cấu tạo của H2O là H – O – H
Phương pháp giải:
Bước 1: Xác định tổng electron hóa trị trong phân tử NH3
Bước 2: Vẽ khung phân tử
Bước 3: Điền các electron hóa trị chưa tham gia liên kết vào các nguyên tử xung quanh
Bước 4: Tính số electron hóa trị còn lại
Lời giải chi tiết:
Bước 1: N có 5 electron hóa trị, H có 1 electron hóa trị
=> Tổng electron hóa trị NH3 = 5 + 1.3 = 8 electron
Bước 2: Vẽ khung phân tử với các liên kết đơn
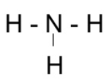
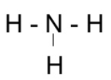
Bước 4:
- Số electron hóa trị còn lại = 8 – 2.3 = 2
=> Chuyển 2 electron còn lại vào nguyên tử N để đạt octet, thu được công thức Lewis của phân tử NH3
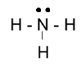
CH mục I CH3
Viết các công thức Lewis cho mỗi phân tử sau:
a) Cl2, N2
b) SO2, SO3
c) H2O, H2S, HOCl
Phương pháp giải:
Bước 1: Xác định tổng electron hóa trị trong phân tử
Bước 2: Vẽ khung phân tử
Bước 3: Điền các electron hóa trị chưa tham gia liên kết vào các nguyên tử xung quanh
Bước 4: Tính số electron hóa trị còn lại
Lời giải chi tiết:
a) Cl2
Bước 1: Cl có 7 electron hóa trị
=> Tổng electron hóa trị Cl2 = 7.2 = 14 electron
Bước 2: Vẽ khung phân tử với các liên kết đơn
Cl - Cl
Bước 3: Mỗi nguyên tử Cl cần 6 electron hóa trị để đạt octet
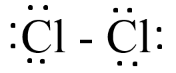
Bước 4:
- Số electron hóa trị còn lại = 14 – 2.6 – 1.2 = 0
=> Công thức Lewis của Cl2
N2
Bước 1: N có 5 electron hóa trị
=> Tổng electron hóa trị N2 = 5.2 = 10 electron
Bước 2: Vẽ khung phân tử với các liên kết đơn
N - N
Bước 3: Hoàn thiện octet cho nguyên tử N
Bước 4:
- Số electron hóa trị còn lại là: 10 – 6.2 – 2.1 = - 4
- Số electron hóa trị của nguyên tử N là 5, nên để đạt octet mỗi nguyên tử N sẽ góp chung 3 electron hóa trị để tạo liên kết với nhau.
Công thức Lewis của phân tử N2 là
b) SO2
Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị
=> Tổng electron hóa trị SO2 = 6 + 6.2 = 18 electron
Bước 2: Vẽ khung phân tử với các liên kết đơn
O – S - O
Bước 3: Hoàn thiện octet cho nguyên tử O
Bước 4:
- Số electron hóa trị còn lại là: 18 – 6.2 – 2.2 = 2
- Nguyên tử S có 4 electron hóa trị nên 1 nguyên tử O sẽ dùng 1 cặp electron để tạo liên kết với S và nguyên tử S còn 1 đôi electron chưa tham gia liên kết.
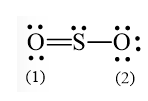
SO3
Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O
⇒ Tổng số electron hóa trị = 1.6 + 3.6 = 24 electron
Bước 3: Mỗi nguyên tử O cần 6 electron để đạt octet.
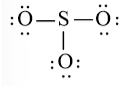
Bước 4: Số electron hóa trị còn lại là: 24 – 2.3 – 6.3 = 0
Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O tạo thành cặp electron dùng chung.
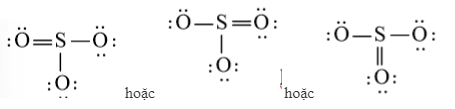
c) H2O
Bước 1. Tổng số electron hóa trị là 1.2 + 1.6 = 8
Bước 2. Trong phân tử H2O, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron hóa trị để đạt octet. Vì vậy, O là nguyên tử trung tâm, còn các nguyên tử H được xếp xung quanh.
H – O – H.
Bước 3. Nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại là: 8 – 2.2 = 4
Nguyên tử O có 4 electron hóa trị nên sẽ chuyển 4 electron còn lại cho O để nguyên tử O đạt octet.
Công thức Lewis của H2O là:
H2S
Bước 1. Tổng số electron hóa trị của phân tử = 1.2 + 1.6 = 8 electron
Bước 2. Trong phân tử H2S, nguyên tử S cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, nguyên tử S là nguyên tử trung tâm, còn 2 nguyên tử H được xếp xung quanh:
H – S – H
Bước 3. 2 nguyên tử H đã đạt octet.
Bước 4. Số electron hóa trị còn lại = 8 – 2.2 = 4
Nguyên tử S có 4 electron hóa trị nên để đạt octet thì chuyển 4 electron còn lại cho nguyên tử S.
Công thức Lewis của H2S là:
HOCl
Bước 1. Tổng số electron hóa trị của phân tử = 1.1 + 1.6 + 1.7 = 14 electron.
Bước 2. Trong phân tử HOCl, nguyên tử Cl cần 1 electron để đạt octet, nguyên tử O cần 2 electron để đạt octet, nguyên tử H cần 1 electron để đạt octet. Vì vậy, O là nguyên tử trung tâm, nguyên tử H và Cl được xếp xung quanh:
H – O – Cl
Bước 3. Nguyên tử H đã đạt octet, nguyên tử Cl cần 6 electron hóa trị để đạt octet:
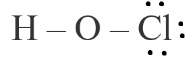
Bước 4. Số electron hóa trị còn lại = 14 – 2.2 – 3.2 = 4
Nguyên tử O có 4 electron hóa trị nên sẽ chuyển 4 electron còn lại cho O để nguyên tử O đạt octet.
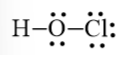
CH mục I CH4
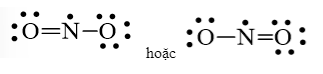
Công thức Lewis của NO2 là

Phương pháp giải:
Phương pháp giải:
Bước 1: Xác định tổng electron hóa trị trong phân tử
Bước 2: Vẽ khung phân tử
Bước 3: Điền các electron hóa trị chưa tham gia liên kết vào các nguyên tử xung quanh
Bước 4: Tính số electron hóa trị còn lại
Lời giải chi tiết:
Bước 1: Tổng số electron hóa trị trong phân tử = 1.5 + 2.6 = 17 electron
Bước 2: Trong phân tử NO2, nguyên tử N cần 3 electron để đạt octet, nguyên tử O cần 2 electron hóa trị để đạt octet. Vì vậy, N là nguyên tử trung tâm, còn các nguyên tử O được xếp xung quanh:
O – N – O
Bước 3: Mỗi nguyên tử O cần 6 electron hóa trị để đạt octet:
Bước 4: Số electron hóa trị còn lại là 17 – 6.2 – 2.2 = 1
Mà nguyên tử N chưa đạt octet nên 1 nguyên tử O sẽ dùng 1 cặp electron hóa trị để tạo liên kết với nguyên tử N và trên nguyên tử N vẫn còn 1 electron chưa tham gia liên kết.
Công thức Lewis của NO2 là
Đáp án C
CH mục II CH5
Công thức của PCl3 theo mô hình VSEPR là
A. AX3
B. AXE2
C. AX3E
D. AX2E
Phương pháp giải:
E là cặp electron hóa trị chưa liên kết của nguyên tử P
Công thức Lewis của PCl3 là
Lời giải chi tiết:
Công thức Lewis của PCl3 là
Theo mô hình VSEPR, công thức phân tử của PCl3 có dạng AX3E vì có 3 nguyên tử Cl liên kết với nguyên tử trung tâm P và có nguyên tử P có 1 cặp electron hóa trị chưa tham gia liên kết.
Đáp án C
CH mục II CH6
Viết công thức của một số phân tử sau theo mô hình VSEPR: CCl4, H2S, CO2, SO3 và PH3. Nêu số cặp electron hóa trị liên kết và chưa liên kết trong mỗi phân tử
Lời giải chi tiết:
Công thức Lewis của CCl4 là:
Phân tử CCl4: có 4 nguyên tử Cl liên kết với nguyên tử trung tâm C và nguyên tử C không còn cặp electron hóa trị chưa tham gia liên kết nên theo mô hình VSEPR có dạng AX4.
⇒ Số cặp electron hóa trị liên kết là 4.
Công thức Lewis của H2S là:
Phân tử H2S: có 2 nguyên tử H liên kết với nguyên tử trung tâm S và nguyên tử S còn 2 cặp electron hóa trị chưa tham gia liên kết nên theo mô hình VSEPR có dạng AX2E2.
⇒ Số cặp electron hóa trị liên kết là 2.
Công thức Lewis của CO2 là:
Phân tử CO2: có 2 nguyên tử O liên kết với nguyên tử trung tâm C và nguyên tử C không còn cặp electron hóa trị chưa liên kết nên theo mô hình VSEPR có dạng AX2.
⇒ Số cặp electron hóa trị liên kết là 4.
Công thức Lewis của SO3 là:
Phân tử SO3: có 3 nguyên tử O liên kết với nguyên tử trung tâm S và nguyên tử S không còn cặp electron hóa trị chưa liên kết nên theo mô hình VSEPR có dạng AX3.
⇒ Số cặp electron hóa trị liên kết là 6.
Công thức Lewis của PH3 là:
Phân tử PH3: có 3 nguyên tử H liên kết với nguyên tử trung tâm P và nguyên tử P còn 1 cặp electron hóa trị chưa tham gia liên kết nên theo mô hình VSEPR có dạng AX3E.
⇒ Số cặp electron hóa trị liên kết là 3.
CH mục II CH7
Viết công thức theo mô hình VSEPR và cho biết dạng hình học của phân tử OF2. Phân tử này có phân cực không?
Phương pháp giải:
Bước 1: Viết công thức Lewis
Bước 2: Viết công thức VSEPR dưới dạng AXnEm
Bước 3: Các cặp electron chưa liên kết chiếm không gian lớn hơn so với cặp electron liên kết, làm giảm góc liên kết của phân tử
Lời giải chi tiết:
Công thức Lewis của OF2 là:
Trong phân tử OF2 có 2 nguyên tử F liên kết với nguyên tử trung tâm O và xung quanh nguyên tử trung tâm O có 2 cặp electron chưa liên kết nên công thức VSEPR của OF2 là AX2E2.
Do cặp electron chưa tham gia liên kết chiếm khoảng không gian lớn hơn so với cặp electron liên kết, tương tác đẩy giữa cặp electron chưa liên kết lớn hơn tương tác đẩy giữa cặp electron liên kết, nên góc liên kết FOF thực tế bằng 104,5o, nhỏ hơn góc hóa trị theo lí thuyết (109,5o). Phân tử có dạng góc.
⇒ Phân tử OF2 phân cực do phân tử dạng góc và liên kết O – F phân cực.
CH mục II CH8
Dạng hình học của ion NH4+ là
A. tứ diện đều
B. tháp tam giác
C. tam giác phẳng
D. đường thẳng
Phương pháp giải:
N là nguyên tử trung tâm, liên kết với 4H bằng 4 cặp electron, theo mô hình VSEPR có dạng AX4
Lời giải chi tiết:
Ion NH4+ gồm có 4 nguyên tử H liên kết với nguyên tử trung tâm N bằng 4 cặp electron liên kết (theo mô hình VSEPR có dạng AX4), chiếm bốn khu vực tích điện âm đẩy nhau để góc hóa trị lớn nhất là 109,5o. Bốn cặp electron được phân bố hướng về 4 đỉnh của tứ diện, phân tử có cấu trúc tứ diện, tâm tứ diện là nguyên tử trung tâm N.
Đáp án A
Ion NH4+ gồm có 4 nguyên tử H liên kết với nguyên tử trung tâm N bằng 4 cặp electron liên kết (theo mô hình VSEPR có dạng AX4), chiếm bốn khu vực tích điện âm đẩy nhau để góc hóa trị lớn nhất là 109,5o. Bốn cặp electron được phân bố hướng về 4 đỉnh của tứ diện, phân tử có cấu trúc tứ diện, tâm tứ diện là nguyên tử trung tâm N.
CH mục II CH9
Dự đoán dạng hình học của một số phân tử sau: CO2, CS2, BF3, SCl2
Phương pháp giải:
Cần phải xác định được nguyên tử trung tâm còn bao nhiêu cặp electron chưa tham gia liên kết
Lời giải chi tiết:
Phân tử CO2 theo mô hình VSEPR có dạng AX2 nên phân tử có cấu trúc thẳng.
Phân tử CS2 theo mô hình VSEPR có dạng AX2 nên phân tử có cấu trúc thẳng.
Phân tử BF3 theo mô hình VSEPR có dạng AX3 nên phân tử có cấu trúc tam giác phẳng.
Phân tử SCl2 theo mô hình VSEPR có dạng AX2E2 nên phân tử có dạng góc.
CH mục III CH10
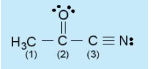
Các nguyên tử carbon (1), (2), (3) trong hình bên ở những trạng thái lai hóa nào?
Phương pháp giải:
- Nguyên tử carbon có thể có cả ba trạng thái lai hóa. Ví dụ
+ Lai hóa sp3 trong trường hợp nguyên tử C có liên kết đơn (CH3 – CH3)
+ Lai hóa sp2 trong trường hợp nguyên tử C có liên kết đôi (CH2 = CH2)
+ Lai hóa sp trong trường hợp nguyên tử C có liên kết ba (CH ≡ CH)
Lời giải chi tiết:
C (1) lai hóa sp3 bởi vì C này chỉ tạo liên kết đơn.
C (2) lai hóa sp2 bởi vì C này có tạo liên kết đôi.
C (3) lai hóa sp bởi vì C này có tạo liên kết ba.
CH mục III CH11
Mô tả sự tạo thành các phân tử sau theo khái niệm lai hóa orbital
a) Phân tử BeH2
b) Phân tử SO2
c) Phân tử NH3
Phương pháp giải:
- Lai hóa sp3: 1 AO s tổ hợp với 3 AO p trong một nguyên tử
- Lai hóa sp2: 1 AO s tổ hợp với 2 AO p trong một nguyên tử
- Lai hóa sp: 1 AO s tổ hợp với 1 AO p trong một nguyên tử
Lời giải chi tiết:
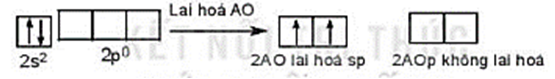
a) Phân tử BeH2.
Cấu hình electron hóa trị của Be: 2s2.
Trong nguyên tử Be, một AO 2s tổ hợp với 1 AO 2p, tạo ra hai AO lai hóa sp.
Hai AO lai hóa sp của nguyên tử Be xen phủ với hai AO s của hai nguyên tử H tạo thành hai liên kết σ giữa Be – H.
b) Phân tử SO2.
Cấu hình electron hóa trị của S: 3s23p4.
Trong nguyên tử S, một AO 3s lai hóa với hai AO p, tạo ra ba AO lai hóa sp2.
S còn AO p chứa 1 electron độc thân sẽ xen phủ 1 AO p chứa 1 electron độc thân của O hình thành liên kết π và AO chưa lai hóa có 1 electron độc thân sẽ tiếp tục xen phủ với OA p của nguyên tử O đó để hình thành liên kết σ. Với nguyên tử O còn lại thì nguyên tử S dùng AO chứa 2 electron để xen phủ với 2 AO chứa electron độc thân của nguyên tử O còn lại.
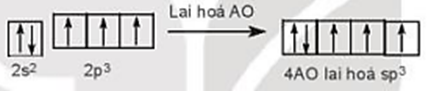
c) Phân tử NH3.
Cấu hình electron hóa trị của N: 2s22p3.
Trong nguyên tử N, 1 AO 2s và 3 AO 2p của nguyên tử N lai hóa với nhau tạo nên 4 AO lai hóa sp3 giống hệt nhau, hướng về 4 đỉnh của hình tứ diện đều. Trên 3 AO lai hóa có electron độc thân. Trên AO lai hóa còn lại có cặp electron ghép đôi.
Ba AO lai hóa chứa electron độc thân của nguyên tử N xen phủ với 3 AO 1s chứa electron độc thân của 3 nguyên tử H, tạo nên 3 liên kết σ.
CH mục III CH12
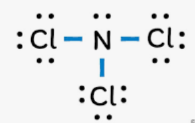
Cho các phân tử NCl3, SO3, CO2
a) Nguyên tử trung tâm trong các phân tử trên ở trạng thái lai hóa nào?
b) Phân tử nào không phân cực, phân tử nào phân cực? Vì sao?
Phương pháp giải:
- Tính số liên kết và số cặp electron hóa trị chưa tham gia liên kết (liên kết đôi, đơn, ba đều coi là 1 liên kết)
+ Tổng là 4: sp3
+ Tổng là 3: sp2
+ Tổng là 2: sp
Lời giải chi tiết:
a)
Trong phân tử NCl3, nguyên tử N là nguyên tử trung tâm, tham gia 3 liên kết với 3 nguyên tử H và còn 1 cặp electron chưa tham gia liên kết => lai hóa sp3.
Trong phân tử SO3, nguyên tử S là nguyên tử trung tâm, tham gia 3 liên kết với 3 nguyên tử O => lai hóa sp2.
Trong phân tử CO2, nguyên tử C là nguyên tử trung tâm, tham gia 2 liên kết với 2 nguyên tử O => lai hóa sp.
b)
Phân tử NCl3, SO3 phân cực vì liên kết giữa nguyên tử trung tâm với nguyên tử còn lại là liên kết phân cực.
Phân tử CO2 không phân cực vì hai liên kết phân cực C = O bị triệt tiêu do phân tử có dạng đường thẳng.
Luyện Bài Tập Trắc nghiệm Hóa 10 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Bài 8. Phòng chống cháy, nổ - Chuyên đề học tập Hóa 10 Kết nối tri thức
- Bài 7. Hóa học về phản ứng cháy nổ - Chuyên đề học tập Hóa 10 Kết nối tri thức
- Bài 6. Điểm chớp cháy. Nhiệt độ ngọn lửa, nhiệt độ tự bốc cháy - Chuyên đề học tập Hóa 10 Kết nối tri thức
- Bài 5. Sơ lược về phản ứng cháy, nổ - Chuyên đề học tập Hóa 10 Kết nối tri thức
- Bài 4. Entropy và biến thiên năng lượng tự do Gibbs - Chuyên đề học tập Hóa 10 Kết nối tri thức
- Bài 8. Phòng chống cháy, nổ - Chuyên đề học tập Hóa 10 Kết nối tri thức
- Bài 7. Hóa học về phản ứng cháy nổ - Chuyên đề học tập Hóa 10 Kết nối tri thức
- Bài 6. Điểm chớp cháy. Nhiệt độ ngọn lửa, nhiệt độ tự bốc cháy - Chuyên đề học tập Hóa 10 Kết nối tri thức
- Bài 5. Sơ lược về phản ứng cháy, nổ - Chuyên đề học tập Hóa 10 Kết nối tri thức
- Bài 4. Entropy và biến thiên năng lượng tự do Gibbs - Chuyên đề học tập Hóa 10 Kết nối tri thức






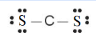
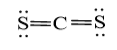
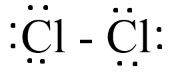
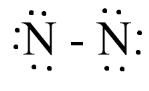
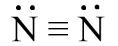
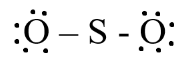
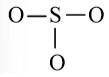
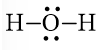
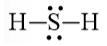
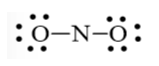
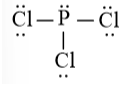
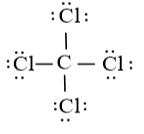
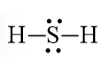
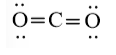
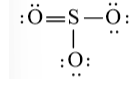
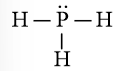
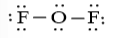
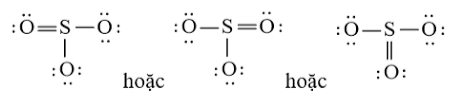
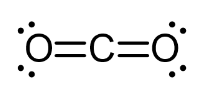








Danh sách bình luận