Lý thuyết Mol và tỉ khối của chất khí - Khoa học tự nhiên 8 Cánh diều
Khái niệm mol
I. Khái niệm mol
Mol là lượng chất có chứa 6,022 x 1023 hạt vi mô (nguyên tử, phân tử,…) của chất đó.
Ví dụ: 1 nguyên tử đồng (Cu) là lượng đồng có chứa 6,022 x 1023 nguyên tử Cu
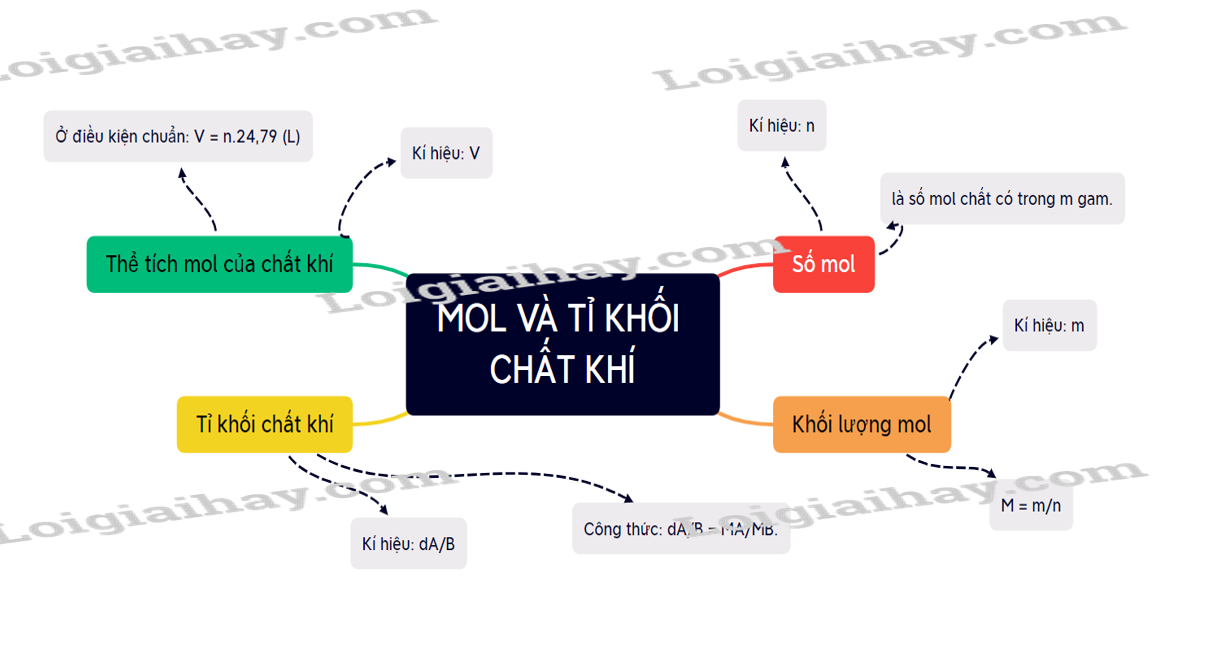
II. Khối lượng mol
Khối lượng mol (kí hiệu là M) của một chất là khối lượng bằng gam của N nguyên tử hoặc phân tử chất đó
Ví dụ: Khối lượng nguyên tử oxygen là 16 amu, khối lượng mol nguyên tử của oxygen là 16 gam/mol.
III. Chuyển đổi giữa số mol chất và khối lượng
Nếu đặt n là số mol chất, M là khối lượng mol chất và m là khối lượng chất, ta có công thức:
\(n = \frac{m}{M}(mol) \to m = n.M(gam);M = \frac{m}{n}(gam/mol)\)
IV. Thể tích mol của chất khí
Một mol của bất kì chất khí nào cũng chiếm những thể tích bằng nhau khi ở cùng điều kiện nhiệt độ và áp suất.
V. Chuyển đổi giữa lượng chất và thể tích chất khí
Ở điều kiện chuẩn ( áp suất 1 bar và nhiệt độ 250C), nếu đặt n là số mol chất khí, V là thể tích chất khí ở cùng điều kiện chuẩn thì ta có biểu thức:
V = 24,79 x n (lít) à n = V/24,79 (mol)
VI. Tỉ khối của chất khí
Tỉ khối của khí A đối với khí B là tỉ số giữa khối lượng mol của khí A và khối lượng mol của khí B
Tỉ khối của khí A đối với khí B được kí hiệu là dA/B và được tính bằng biểu thức:
\({d_{A/B}} = \frac{{{M_A}}}{{{M_B}}}\)
Tỉ khối của một khí với không khí
\({d_{X/khongkhi}} = \frac{{{M_X}}}{{29}}\)
Các bài khác cùng chuyên mục
- Lý thuyết Khái quát về sinh quyển và các khu sinh học - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Cân bằng tự nhiên và bảo vệ môi trường - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Hệ sinh thái - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Sự nở vì nhiệt - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Quần xã sinh vật - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Khái quát về sinh quyển và các khu sinh học - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Cân bằng tự nhiên và bảo vệ môi trường - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Hệ sinh thái - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Sự nở vì nhiệt - Khoa học tự nhiên 8 Cánh diều
- Lý thuyết Quần xã sinh vật - Khoa học tự nhiên 8 Cánh diều












Danh sách bình luận