Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của NO(g)?
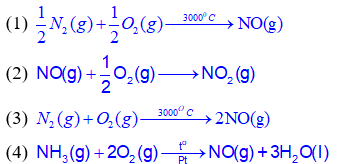
-
A.
(4)
-
B.
(3).
-
C.
(2).
-
D.
(1)
Đáp án : D
Dựa vào khái niệm enthalpy tạo thành chuẩn của chất
(1) là phản ứng enthalpy tạo thành chuẩn của NO
Đáp án D
Các bài tập cùng chuyên đề
Có nhiều vụ tai nạn giao thông xảy ra do người lái xe uống rượu. Theo luật định, hàm lượng ethanol
trong máu người lái xe không vượt quá 0,02% theo khối lượng. Để xác định hàm lượng ethanol trong máu của người lái xe cần chuẩn độ ethanol bằng K2Cr2O7 trong môi trường acid. Khi đó Cr+6 bị khử thành Cr+3, ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).
(a) Hãy viết phương trình hóa học của phản ứng.
(b) Khi chuẩn độ 25 gam huyết tương máu của một lái xe cần dùng 20 ml dung dịch K2Cr2O70,01M.
Người lái xe đó có vi phạm luật không? Tại sao?
Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7.
Cho 2,34g kim loại M (hóa trị n) tác dụng với dung dịch H2SO4 (đặc, nóng dư) thu được 3,2227 L khí SO2 (điều kiện chuẩn). Xác định kim loại M.
Nguyên tố Floruine có thể có những số oxi hóa là -1 và 0. Vậy phân tử F2 thể hiện tính chất nào sau đây ?
Cho phương trình hoá học: Cu + HNO3 \( \to \) Cu(NO3)2 + NO + H2O
Tổng hệ số cân bằng (nguyên, tối giản) của phản ứng là
Cho phản ứng hoá học: \(C{l_2} + KOH \to KCl + KCl{O_3} + {H_2}O.\)
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò chất khử trong phương trình hoá học của phản ứng đã cho tương ứng là
Cho 3,16 gam KMnO4 tác dụng với dung dịch HCl (dư), sau khi phản ứng xảy ra hoàn toàn thì số mol HCl bị oxi hóa là
Cho phương trình nhiệt hoá học của phản ứng.
2H2(g) + O2 (g) → 2H2O (l) \({\Delta _r}H_{298}^0\) = - 571,68 kJ
Phản ứng trên là phản ứng
Cho phương trình hoá học của phản ứng:
C2H4 (g) + H₂O (l) → C2H5OH (I)
Biết nhiệt tạo thành chuẩn của các chất trên cho ở bảng sau đây :

Biến thiên enthalpy của phản ứng theo nhiệt tạo thành chuẩn của các chất trên là :
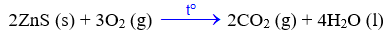
\({\Delta _r}H_{298}^0\) = -285,66 kJ
Xác định giá trị của \({\Delta _r}H_{298}^0\) khi lấy gấp 3 lần khối lượng của các chất phản ứng.

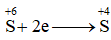 , đây là quá trình
, đây là quá trình




