Nghiên cứu ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Chuẩn bị: 2 bình tam giác, dung dịch HCl 0,5 M, đá vôi dạng viên, đá vôi đập nhỏ.
Tiến hành:
- Cho cùng một lượng (khoảng 2 g) đá vôi dạng viên vào bình tam giác (1) và đá vôi đập nhỏ vào bình tam giác (2).
- Rót 20 mL dung dịch HCl 0,5 M vào mỗi bình.
Quan sát hiện tượng và trả lời câu hỏi:
a) Phản ứng trong bình 1 có tốc độ thoát khí nhanh hơn.
b) Đá vôi dạng đập nhỏ có tổng diện tích bề mặt lớn hơn.
c) Diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm.
d) Phản ứng trên thuộc loại phản ứng oxi hóa – khử
a) Phản ứng trong bình 1 có tốc độ thoát khí nhanh hơn.
b) Đá vôi dạng đập nhỏ có tổng diện tích bề mặt lớn hơn.
c) Diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm.
d) Phản ứng trên thuộc loại phản ứng oxi hóa – khử
(a) sai, vì diện tích tiếp xúc của đá vôi dạng viên ít hơn so với đập nhỏ
(b) đúng
(c) sai, diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm
(d) sai, phản ứng trên không phản ứng ứng oxi hóa khử vì không có sự trao đổi electron
Các bài tập cùng chuyên đề
Cho phản ứng: 2SO2(g) + O2(g) 2SO3(g). Nồng độ của sulfur dioxide tăng 2 lần và oxygen tăng 3 lần thì tốc độ phản ứng tăng lên bao nhiêu lần?
Hệ số nhiệt độ của tốc độ phản ứng bằng 3,5. Ở 150C tốc độ phản ứng này bằng 0,2 s-1. Tính tốc độ phản ứng ở 400C.
Từ MnO2, HClđặc, Fe hãy viết các phương trình phản ứng điều chế Cl2, FeCl2 và FeCl3.
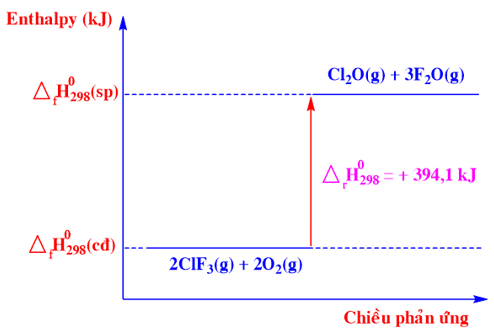
Phương trình nhiệt hoá học nào sau đây ứng với sơ đồ biểu diễn biến thiên enthalpy của phản ứng sau:
Cho 5 gam kẽm viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25oC).
Trường hợp nào tốc độ phản ứng không đổi ?
Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P):
P(s, đỏ) \( \to \)P (s, trắng) \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = 17,6 kJ
Điều này chứng tỏ phản ứng:
Cho 5,6 gam kim loại sắt vào dung dịch hydrochloric acid, sau phản ứng thu được V lít khí ở đkc. Giá trị của V là:
Từ HF đến HI, tính acid của các dung dịch hydrogen halide biến đổi như thế nào?
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO(g) + 1/2O2(g) → CO2(g) \({\Delta _r}H_{298}^0 = - 283,0kJ\)
Biết nhiệt tạo thành chuẩn của CO2 là -393,5 kJ/mol. Nhiệt tạo thành chuẩn của CO là
Cho các yếu tố: nhiệt độ, áp suất, diện tích bề mặt tiếp xúc, chất xúc tác, nồng độ. Có bao nhiêu yếu tố có thể ảnh hưởng đến tốc độ của phản ứng?
Trong các phản ứng hoá học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron?
Một phản ứng có hệ số nhiệt độ Van’t Hoff là γ = 3. Khi nhiệt độ tăng 10oC, tốc độ của phản ứng trên sẽ






