Đề thi giữa kì 2 Hóa 11 - Đề số 2
Đề bài
C5H8 có số đồng phân là ankađien liên hợp là
-
A.
2
-
B.
5
-
C.
4
-
D.
3
Trùng hợp 60 kg propilen thu được m kg polime, biết H = 70%. Giá trị của m là
-
A.
42,0 kg.
-
B.
29,4 kg.
-
C.
84,0 kg.
-
D.
60,0 kg.
Trong phòng thí nghiệm có thể điều chế metan bằng cách nào sau đây ?
-
A.
Nhiệt phân natri axetat với vôi tôi xút.
-
B.
Crackinh butan.
-
C.
Cho nhôm cacbua tác dụng với nước.
-
D.
Nhiệt phân natri axetat với vôi tôi xút hoặc cho nhôm cacbua tác dụng với nước.
Phản ứng oxi hóa hoàn toàn là
-
A.
CH4 + O2 \(\xrightarrow{{xt,{t^o}}}\) CH2O + H2O
-
B.
2C4H10 + 5O2 \(\xrightarrow{{xt,{t^o}}}\) 4C2H4O2 + 2H2O
-
C.
2C2H6 + 12O2 \(\xrightarrow{{xt,{t^o}}}\) 3C + 9CO2 + 6H2O
-
D.
C3H8 + 5O2 \(\xrightarrow{{xt,{t^o}}}\) 3CO2 + 4H2O
X có công thức phân tử là C5H8. Biết rằng X thỏa mãn các điều kiện sau
- Làm mất màu dung dịch Br2
- Cộng H2 theo tỷ lệ 1:2
- Cộng H2O (xúc tác) tạo xeton
- Tạo kết tủa với dung dịch AgNO3/NH3
Công thức cấu tạo của X là
-
A.
\(C{H_2} = CH - CH = CH - C{H_3}\)
-
B.
\(C{H_2} = C = CH - C{H_2} - C{H_3}\)
-
C.
\(CH \equiv C - C{H_2} - C{H_2} - C{H_3}\)
-
D.
\(C{H_3} - C \equiv C - C{H_2} - C{H_3}\)
Số đồng phân anken của C4H8 là
-
A.
7.
-
B.
4.
-
C.
6.
-
D.
5.
Công thức đơn giản nhất của một hiđrocacbon là CnH2n+1. Hiđrocacbon đó thuộc dãy đồng đẳng của:
-
A.
ankan.
-
B.
ankin.
-
C.
ankađien.
-
D.
anken.
Ankin X có % khối lượng cacbon gấp 8 lần % khối lượng của hiđro. X có bao nhiêu công thức cấu tạo?
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đốt cháy một hợp chất hữu cơ X trong oxi vừa đủ, người ta thấy thoát ra khí CO2, hơi H2O và khí N2. Chọn kết luận chính xác nhất trong các kết luận sau :
-
A.
X chắc chắn chứa C, H, N và có thể có hoặc không có oxi.
-
B.
X là hợp chất của 3 nguyên tố C, H, N.
-
C.
Chất X chắc chắn có chứa C, H, có thể có N.
-
D.
X là hợp chất của 4 nguyên tố C, H, N, O.
Có bao nhiêu ankađien liên hợp có phân tử khối là 68 ?
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Hãy chọn phát biểu đúng nhất về hoá học hữu cơ trong số các phát biểu sau :
-
A.
Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon.
-
B.
Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon, trừ cacbon (II) oxit, cacbon (IV) oxit, muối cacbonat, xianua, cacbua.
-
C.
Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon, trừ cacbon (II) oxit, cacbon (IV) oxit.
-
D.
Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon trừ muối cacbonat.
Cho dãy chuyển hóa sau:
\(C{H_4} \to A \to B \to C \to \) cao su buna
Công thức phân tử của B là
-
A.
C4H6
-
B.
C2H5OH
-
C.
C4H4
-
D.
C4H10
Công thức phân tử tổng quát của ankin là
-
A.
CnH2n-2 (n ≥ 3).
-
B.
CnH2n-2 (n ≥ 2).
-
C.
CnH2n-6 (n ≥ 4).
-
D.
CnH2n (n ≥ 2).
Hợp chất chỉ chứa liên kết \(\sigma \) trong phân tử thuộc loại hợp chất
-
A.
không no
-
B.
mạch vòng
-
C.
thơm
-
D.
no
Để làm sạch etilen có lẫn axetilen, ta cho hỗn hợp đi qua dung dịch
-
A.
dung dịch brom dư.
-
B.
dung dịch KMnO4 dư.
-
C.
dung dịch AgNO3/NH3 dư.
-
D.
cả A, B, C đều đúng.
Thành phần chính của “khí thiên nhiên” là
-
A.
metan
-
B.
etan
-
C.
propan
-
D.
n - butan
Ứng với công thức phân tử C5H10 có bao nhiêu anken đồng phân cấu tạo?
-
A.
4.
-
B.
5.
-
C.
3.
-
D.
7.
Trong phòng thí nghiệm quá trình điều chế etilen thường có lẫn khí CO2 và SO2. Để loại bỏ CO2 và SO2 người ta cho hỗn hợp khí đi qua dung dịch dư nào sau đây?
-
A.
AgNO3/NH3 .
-
B.
KMnO4.
-
C.
Brom.
-
D.
Ca(OH)2.
Trong số các ankan đồng phân của nhau, đồng phân nào có nhiệt độ sôi cao nhất ?
-
A.
Đồng phân mạch không nhánh
-
B.
Đồng phân mạch phân nhánh nhiều nhất
-
C.
Đồng phân isoankan
-
D.
Đồng phân tert-ankan
Tách benzen (nhiệt độ sôi là 800C) và axit axetic (nhiệt độ sôi là 1180C) ra khỏi nhau có thể dùng phương pháp
-
A.
Chưng cất ở áp suất thấp
-
B.
Chưng cất ở áp suất thường
-
C.
Chiết bằng dung môi hexan
-
D.
Chiết bằng dung môi etanol
Đốt cháy hoàn toàn một hợp chất hữu cơ X cần 6,72 lít O2 (đktc). Sản phẩm cháy hấp thụ hết vào bình đựng dung dịch Ba(OH)2 thấy có 19,7 gam kết tủa xuất hiện và khối lượng dung dịch giảm 5,5 gam. Lọc bỏ kết tủa, đun nóng nước lọc lại thu được 9,85 gam kết tủa nữa. CTPT của X là:
-
A.
C2H6.
-
B.
C2H6O.
-
C.
C2H6O2.
-
D.
Không thể xác định.
Cho các chất sau: CH2=CH-CH2-CH2-CH=CH2; CH2=CH-CH=CH-CH2-CH3, CH3-C(CH3)=CH-CH3, CH2=CH-CH2-CH=CH2. Số chất có đồng phân hình học là
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Khi brom hóa một ankan chỉ thu được một dẫn xuất monobrom duy nhất có tỉ khối hơi đối với hiđro là 75,5. Tên của ankan đó là
-
A.
3,3-đimetylhexan.
-
B.
isopentan.
-
C.
2,2,3-trimetylpentan.
-
D.
2,2-đimetylpropan
Hợp chất Y có công thức cấu tạo :
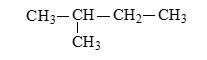
Y có thể tạo được bao nhiêu dẫn xuất monohalogen đồng phân của nhau ?
-
A.
3.
-
B.
4.
-
C.
5.
-
D.
6.
Khi đốt cháy hoàn toàn 3,60g ankan X thu được 5,60 lít khí CO2 (ở đktc). Công thức phân tử của X là trường hợp nào sau đây?
-
A.
C3H8
-
B.
C5H10
-
C.
C5H12
-
D.
C4H10
Crackinh 560 lít butan, xảy ra đồng thời các phản ứng:
\({C_4}{H_{10}} \to {H_2} + {C_4}{H_8}\)
\({C_4}{H_{10}} \to C{H_4} + {C_3}{H_6}\)
\({C_4}{H_{10}} \to {C_2}{H_6} + {C_2}{H_4}\)
Sau phản ứng thu được 896 lít hỗn hợp khí X. Thể tích C4H10 có trong hỗn hợp X là (các thể tích đo ở cùng điều kiện)
-
A.
336 lít
-
B.
168 lít
-
C.
280 lít
-
D.
224 lít
Crackinh 8,8 gam propan thu được hỗn hợp A gồm H2, CH4, C2H4, C3H6 và một phần propan chưa bị crackinh. Biết hiệu suất phản ứng là 90%. Khối lượng phân tử trung bình của A là:
-
A.
39,6.
-
B.
23,16.
-
C.
2,315.
-
D.
3,96.
Đốt cháy hoàn toàn a gam hỗn hợp A gồm eten, propen, but-2-en cần dùng vừa đủ b lít khí oxi (ở đktc) thu được 2,4 mol CO2. Giá trị của b là
-
A.
92,4 lít
-
B.
94,2 lít.
-
C.
80,64 lít.
-
D.
24,9 lít.
Cho 3,36 lít hỗn hợp etan và etilen (đktc) đi chậm qua qua dung dịch brom dư. Sau phản ứng khối lượng bình brom tăng thêm 2,8 gam. Số mol etan và etilen trong hỗn hợp lần lượt là:
-
A.
0,05 và 0,1.
-
B.
0,12 và 0,03.
-
C.
0,1 và 0,05.
-
D.
0,03 và 0,12.
Anken khi tác dụng với nước cho duy nhất một ancol là
-
A.
CH2=C(CH3)2
-
B.
CH3-CH=CH-CH3
-
C.
CH2=CH-CH2-CH3
-
D.
CH3-CH=C(CH3)2
Hỗn hợp gồm 1 ankan (x mol) và 1 mol ankađien (x mol) đem đốt cháy hoàn toàn sẽ thu được
-
A.
\({n_{C{O_2}}} > {n_{{H_2}O}}\)
-
B.
\({n_{C{O_2}}} < {n_{{H_2}O}}\)
-
C.
\({n_{C{O_2}}} = {n_{{H_2}O}}\)
-
D.
\({n_{C{O_2}}} \ge {n_{{H_2}O}}\)
Hỗn hợp khí X gồm hai hiđrocacbon kế tiếp nhau trong dãy đồng đẳng. Oxi hóa hoàn toàn m gam hỗn hợp X, sản phẩm cháy cho đi qua bình (1) đựng dung dịch H2SO4 đặc. Bình (2) đựng dung dịch NaOH dư thì thấy khối lượng bình (1) tăng 9 gam và bình (2) tăng 30,8 gam. Phần trăm thể tích của hai khí là
-
A.
50% và 50%
-
B.
25% và 75%
-
C.
15% và 85%
-
D.
65% và 35%
Đốt cháy hoàn toàn m gam hidrocacbon ở thể khí, nhẹ hơn không khí, mạch hở thu được 7,04 gam CO2. Sục m gam hidrocacbon này vào nước brom dư đến phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng. Giá trị của m là
-
A.
3,02
-
B.
2,08
-
C.
3,06
-
D.
2,04
Dẫn 17,4 gam hỗn hợp khí X gồm propin và but-2-in lội thật chậm qua bình đựng dung dịch AgNO3/NH3 dư thấy có 44,1 gam kết tủa xuất hiện. Phần trăm thể tích của mỗi khí trong X là
-
A.
C3H4 80% và C4H6 20%
-
B.
C3H4 25% và C4H6 75%
-
C.
C3H4 75% và C4H6 25%
-
D.
kết quả khác
Phân biệt các chất metan, etilen, axetilen bằng phương pháp hóa học, ta dùng
-
A.
dd AgNO3/NH3 và nước brom.
-
B.
dung dịch AgNO3/NH3
-
C.
dd NaOH.
-
D.
dd KMnO4
Nung nóng a mol hỗn hợp X gồm C2H2 và H2 trong bình kín có xúc tác thích hợp thu được hỗn hợp khí Y. Dẫn Y qua lượng dư dung dịch AgNO3 trong NH3, sau khi phản ứng hoàn toàn thu được 24 gam kết tủa và hỗn hợp khí Z. Hỗn hợp Z làm mất màu tối đa 40 gam brom trong dung dịch và còn lại hỗn hợp khí T. Đốt cháy hoàn toàn hỗn hợp T thu được 11,7 gam nước. Giá trị của a là:
-
A.
1,00.
-
B.
0,80.
-
C.
1,50.
-
D.
1,25.
Cho 0,25 mol hỗn hợp X gồm axetilen và một hiđrocacbon Y có tỉ lệ mol 1 : 1 vào dung dịch AgNO3/NH3 dư thu được 63 gam kết tủa vàng. Công thức phân tử hiđrocacbon Y là
-
A.
CH3CH2CH2-C≡CH
-
B.
CH3-CH2-C≡CH
-
C.
CH≡C-CH≡C-CH3
-
D.
CH≡C–C≡CH
Cho hỗn hợp X gồm: etan, propilen, benzen, metylaxetat, axit propanoic. Đốt cháy hoàn toàn m gam hỗn hợp X cần dùng 4,592 lít (đktc) khí O2 thu được hỗn hợp sản phẩm. Cho toàn bộ sản phẩm cháy vào 100 ml dung dịch Ca(OH)2 1M thu được 5 gam kết tủa và một muối của canxi. Sau phản ứng thấy khối lượng dung dịch tăng 4,3 gam. Phần trăm số mol của hỗn hợp (metyl axetat, axit propanoic) trong X là:
-
A.
60 %
-
B.
12,22 %
-
C.
87,78 %
-
D.
40 %
Đốt cháy 13,7 ml hỗn hợp A gồm metan, propan và cacbon (II) oxit, ta thu được 25,7 ml khí CO2 ở cùng điều kiện nhiệt độ và áp suất. Thành phần % thể tích propan trong hỗn hợp A và khối lượng phân tử trung bình của hỗn hợp A so với nitơ là :
-
A.
6% ; bằng 1.
-
B.
6 % ; nhỏ hơn 1.
-
C.
6 % ; lớn hơn 1.
-
D.
94 % ; nhỏ hơn 1.
Đốt cháy hoàn toàn hỗn hợp A (gồm 2 ankin X và Y, số mol của X gấp 1,5 lần số mol của Y). Hấp thụ toàn bộ sản phẩm cháy vào cốc đựng 4,5 lít dd Ca(OH)2 0,02M thu được m1 gam kết tủa và khối lượng dung dịch tăng 3,78 gam. Thêm dung dịch Ba(OH)2 vừa đủ vào cốc, thu được thêm m2 gam kết tủa nữa. Biết m1 + m2 = 18,85 gam. X, Y lần lượt là
-
A.
C3H4 và C4H6.
-
B.
C2H2 và C4H6.
-
C.
C2H2 và C3H4.
-
D.
C4H6 và C2H2.
Lời giải và đáp án
C5H8 có số đồng phân là ankađien liên hợp là
-
A.
2
-
B.
5
-
C.
4
-
D.
3
Đáp án : D
Đồng phân là ankadien liên hợp ứng với CTPT C5H8 là
- H2C=CH-CH=CH-CH3 ( có đồng phân hình học cis-trans)
- H2C=C(CH3)-CH=CH2
Trùng hợp 60 kg propilen thu được m kg polime, biết H = 70%. Giá trị của m là
-
A.
42,0 kg.
-
B.
29,4 kg.
-
C.
84,0 kg.
-
D.
60,0 kg.
Đáp án : A
Bảo toàn khối lượng: mpolime lí thuyết = mpropilen
=> nhân hiệu suất tính mpolime thực tế
nCH2=CH-CH3 → (-CH2-CH(CH3)-)n
Theo lí thuyết: mpolime = mpropilen = 60 kg => mpolime thực tế = 60.70/100 = 42 kg
Trong phòng thí nghiệm có thể điều chế metan bằng cách nào sau đây ?
-
A.
Nhiệt phân natri axetat với vôi tôi xút.
-
B.
Crackinh butan.
-
C.
Cho nhôm cacbua tác dụng với nước.
-
D.
Nhiệt phân natri axetat với vôi tôi xút hoặc cho nhôm cacbua tác dụng với nước.
Đáp án : D
Trong phòng thí nghiệm, CH4 được điều chế bằng cách nung natri axetat với vôi tôi xút.
Phản ứng oxi hóa hoàn toàn là
-
A.
CH4 + O2 \(\xrightarrow{{xt,{t^o}}}\) CH2O + H2O
-
B.
2C4H10 + 5O2 \(\xrightarrow{{xt,{t^o}}}\) 4C2H4O2 + 2H2O
-
C.
2C2H6 + 12O2 \(\xrightarrow{{xt,{t^o}}}\) 3C + 9CO2 + 6H2O
-
D.
C3H8 + 5O2 \(\xrightarrow{{xt,{t^o}}}\) 3CO2 + 4H2O
Đáp án : D
Các phản ứng oxi hóa không hoàn toàn là (A), (B) và (C) vì số oxi hóa của Cacbon trong sản phẩm chưa đạt tối đa
Phản ứng oxi hóa hoàn toàn là (D) vì số oxi hóa của Cacbon trong sản phẩm đã đạt tối đa
X có công thức phân tử là C5H8. Biết rằng X thỏa mãn các điều kiện sau
- Làm mất màu dung dịch Br2
- Cộng H2 theo tỷ lệ 1:2
- Cộng H2O (xúc tác) tạo xeton
- Tạo kết tủa với dung dịch AgNO3/NH3
Công thức cấu tạo của X là
-
A.
\(C{H_2} = CH - CH = CH - C{H_3}\)
-
B.
\(C{H_2} = C = CH - C{H_2} - C{H_3}\)
-
C.
\(CH \equiv C - C{H_2} - C{H_2} - C{H_3}\)
-
D.
\(C{H_3} - C \equiv C - C{H_2} - C{H_3}\)
Đáp án : C
Xem lại phản ứng cộng của ankin
X làm mất màu dung dịch Br2 => mạch hở, có liên kết π
X cộng H2 theo tỉ lệ 1 : 2 => X có 2 liên kết π
X cộng H2O (xúc tác) tạo xeton => X có liên kết ba
X tạo kết tủa với dung dịch AgNO3/NH3 => X có liên kết ba đầu mạch
CTCT của X là: \(CH \equiv C - C{H_2} - C{H_2} - C{H_3}\)
Số đồng phân anken của C4H8 là
-
A.
7.
-
B.
4.
-
C.
6.
-
D.
5.
Đáp án : B
Các đồng phân anken của C4H8
1. CH3-CH2-CH=CH2
2,3. CH3-CH=CH-CH3 (có đphh)
4. (CH3)2C=CH2
Công thức đơn giản nhất của một hiđrocacbon là CnH2n+1. Hiđrocacbon đó thuộc dãy đồng đẳng của:
-
A.
ankan.
-
B.
ankin.
-
C.
ankađien.
-
D.
anken.
Đáp án : A
+) Gọi công thức phân tử của hiđrocacbon cần tìm là (CnH2n+1)a
+) Trong phân tử một hiđrocacbon bất kì luôn chẵn nên k chắn
=> k có thể là 2
=> Công thức phân tử
Gọi CTPT của hidrocacbon là ${({C_n}{H_{2n}}_{ + 1})_{a\,\,\,}}$
Vì số H luôn là số chẵn nên a = 2
=> CTPT: C2nH4n+2
Đặt m = 2n => CTPT là CmH2m+2
=> Ankan hidrocacbon thuộc dãy đồng đẳng ankan
Ankin X có % khối lượng cacbon gấp 8 lần % khối lượng của hiđro. X có bao nhiêu công thức cấu tạo?
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : B
+) Gọi CTPT của X là CnH2n-2
Vì % khối lượng C gấp 8 lần % khối lượng của hidro
\(\dfrac{{\% {m_C}}}{{\% {m_H}}} = \dfrac{{12n}}{{2n - 2}} = 8 \to n\)
+) Từ CTPT của X xác định số công thức cấu tạo thỏa mãn
Gọi CTPT của X là CnH2n-2
Vì % khối lượng C gấp 8 lần % khối lượng của hidro
\( \to \dfrac{{\% {m_C}}}{{\% {m_H}}} = \dfrac{{12n}}{{2n - 2}} = 8 \to n = 4\)
CTCT của ankin C4H6 là
- CH≡C-CH2-CH3
- CH3-C≡C-CH3
Đốt cháy một hợp chất hữu cơ X trong oxi vừa đủ, người ta thấy thoát ra khí CO2, hơi H2O và khí N2. Chọn kết luận chính xác nhất trong các kết luận sau :
-
A.
X chắc chắn chứa C, H, N và có thể có hoặc không có oxi.
-
B.
X là hợp chất của 3 nguyên tố C, H, N.
-
C.
Chất X chắc chắn có chứa C, H, có thể có N.
-
D.
X là hợp chất của 4 nguyên tố C, H, N, O.
Đáp án : A
Vì sau phản ứng thu được CO2, H2O và N2 => chắc chắn trong X chứa C, H và N
X có thể có O
Có bao nhiêu ankađien liên hợp có phân tử khối là 68 ?
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
Ankađien có CTPT CnH2n-2 => M = 14n – 2 = 68 => n = 5 => ankađien là C5H8
Các ankađien liên hợp ứng với công thức phân tử C5H8 là
1. CH2=CH-CH=CH-CH3 (có 2 đồng phân hình học)
2. CH2=C(CH3)CH=CH2
=> có 3 ankađien
Hãy chọn phát biểu đúng nhất về hoá học hữu cơ trong số các phát biểu sau :
-
A.
Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon.
-
B.
Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon, trừ cacbon (II) oxit, cacbon (IV) oxit, muối cacbonat, xianua, cacbua.
-
C.
Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon, trừ cacbon (II) oxit, cacbon (IV) oxit.
-
D.
Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu các hợp chất của cacbon trừ muối cacbonat.
Đáp án : B
Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2, HCN, muối cacbonat, muối xianua, muối cacbua…). Do đó hóa học hữu cơ là hóa học chuyên nghiên cứu các hợp chất của cacbon, trừ cacbon (II) oxit, cacbon (IV) oxit, muối cacbonat, xianua, cacbua.
Cho dãy chuyển hóa sau:
\(C{H_4} \to A \to B \to C \to \) cao su buna
Công thức phân tử của B là
-
A.
C4H6
-
B.
C2H5OH
-
C.
C4H4
-
D.
C4H10
Đáp án : C
Xem lại lí thuyết phản ứng cộng ankin
\(\begin{gathered}C{H_4}\xrightarrow{{ - {H_2},{{1500}^o}C}}CH \equiv CH\xrightarrow{{\dim ehoa}}C{H_2} = CH - C \equiv CH \hfill \\\xrightarrow{{ + {H_2}(Pd/PbC{O_3})}}C{H_2} = CH - CH = C{H_2}\xrightarrow{{{t^o},xt,p}}{\left( { - C{H_2} - CH = CH - C{H_2} - } \right)_n} \hfill \\ \end{gathered} \)
Vậy Y là C4H4
Công thức phân tử tổng quát của ankin là
-
A.
CnH2n-2 (n ≥ 3).
-
B.
CnH2n-2 (n ≥ 2).
-
C.
CnH2n-6 (n ≥ 4).
-
D.
CnH2n (n ≥ 2).
Đáp án : B
Công thức phân tử tổng quát của ankin là CnH2n-2 (n ≥ 2).
Hợp chất chỉ chứa liên kết \(\sigma \) trong phân tử thuộc loại hợp chất
-
A.
không no
-
B.
mạch vòng
-
C.
thơm
-
D.
no
Đáp án : D
Xem lại lí thuyết cấu trúc phân tử HCHC
Hợp chất chỉ chứa liên kết \(\sigma \) trong phân tử thuộc loại hợp chất no.
Để làm sạch etilen có lẫn axetilen, ta cho hỗn hợp đi qua dung dịch
-
A.
dung dịch brom dư.
-
B.
dung dịch KMnO4 dư.
-
C.
dung dịch AgNO3/NH3 dư.
-
D.
cả A, B, C đều đúng.
Đáp án : C
Để làm sạch etilen có lẫn axetilen, ta cho hỗn hợp đi qua dung dịch AgNO3/NH3 dư vì axetilen có phản ứng tạo kết tủa còn etilen không phản ứng
Thành phần chính của “khí thiên nhiên” là
-
A.
metan
-
B.
etan
-
C.
propan
-
D.
n - butan
Đáp án : A
Thành phần chính của khí thiên nhiên là khí metan (CH4)
Ứng với công thức phân tử C5H10 có bao nhiêu anken đồng phân cấu tạo?
-
A.
4.
-
B.
5.
-
C.
3.
-
D.
7.
Đáp án : B
Các đồng phân cấu tạo mạch hở của C5H10 là (không xét đồng phân hình học)
- H2C=CH-CH2-CH2-CH3
- H2C-CH=CH-CH2-CH3
- CH2=CH(CH3)-CH2-CH3
- (CH3)2C=CH-CH3
- (CH3)2CH-CH=CH2
Trong phòng thí nghiệm quá trình điều chế etilen thường có lẫn khí CO2 và SO2. Để loại bỏ CO2 và SO2 người ta cho hỗn hợp khí đi qua dung dịch dư nào sau đây?
-
A.
AgNO3/NH3 .
-
B.
KMnO4.
-
C.
Brom.
-
D.
Ca(OH)2.
Đáp án : D
CO2 + Ca(OH)2 → CaCO3 ↓+ H2O
SO2 + Ca(OH)2 → CaSO3 ↓+ H2O
Etilen không tác dụng với Ca(OH)2
Trong số các ankan đồng phân của nhau, đồng phân nào có nhiệt độ sôi cao nhất ?
-
A.
Đồng phân mạch không nhánh
-
B.
Đồng phân mạch phân nhánh nhiều nhất
-
C.
Đồng phân isoankan
-
D.
Đồng phân tert-ankan
Đáp án : A
mạch cacbon càng dài, diện tích tiếp xúc càng lớn => lực liên kết giữa các phân tử càng lớn => nhiệt độ sôi càng tăng.
Chất có nhiệt độ sôi cao nhất là đồng phân mạch không nhánh
Tách benzen (nhiệt độ sôi là 800C) và axit axetic (nhiệt độ sôi là 1180C) ra khỏi nhau có thể dùng phương pháp
-
A.
Chưng cất ở áp suất thấp
-
B.
Chưng cất ở áp suất thường
-
C.
Chiết bằng dung môi hexan
-
D.
Chiết bằng dung môi etanol
Đáp án : B
Xem lại lí thuyết mở đầu về hóa hữu cơ
Vì hai chất có nhiệt độ sôi khác nhau nên ta có thể dùng phương pháp chưng cất để tách các chất.
Đốt cháy hoàn toàn một hợp chất hữu cơ X cần 6,72 lít O2 (đktc). Sản phẩm cháy hấp thụ hết vào bình đựng dung dịch Ba(OH)2 thấy có 19,7 gam kết tủa xuất hiện và khối lượng dung dịch giảm 5,5 gam. Lọc bỏ kết tủa, đun nóng nước lọc lại thu được 9,85 gam kết tủa nữa. CTPT của X là:
-
A.
C2H6.
-
B.
C2H6O.
-
C.
C2H6O2.
-
D.
Không thể xác định.
Đáp án : B
Bước 1: Tính số mol CO2
- Do đun nóng nước lọc lại thu được thêm kết tủa nên nước lọc có chứa Ba(HCO3)2.
CO2 + Ba(OH)2 → BaCO3 + H2O (1)
2CO2 + Ba(OH)2 → Ba(HCO3)2 (2)
Ba(HCO3)2 \(\xrightarrow{{{t^o}}}\) BaCO3 + CO2 + H2O (3)
=> nCO2 = nBaCO3(1) + 2nBa(HCO3)2 (2) = nBaCO3(1) + 2nBaCO3(3)
Bước 2: Tính số mol H2O
\({m_{dd\,giam}} = {m_{BaC{{\rm{O}}_3}(1)}} - ({m_{C{O_2}}} + {m_{{H_2}O}})\)
Bước 3: Xác định CTĐGN của X
- Từ số mol CO2 và H2O tính được số mol C và H trong X
- Bảo toàn nguyên tố O tính được số mol O trong X (dùng bảo toàn O)
- Lập tỉ lệ nC : nH : nO ⟹ CTĐGN của X.
Bước 4: Biện luận tìm CTPT của X
- Trong hợp chất hữu cơ chứa C, H, O ta luôn có: 0 < H ≤ 2C + 2
⟹ Giá trị của n.
- Kết luận CTPT của X.
Bước 1: Tính số mol CO2
Do đun nóng nước lọc lại thu được thêm kết tủa nên nước lọc có chứa Ba(HCO3)2.
CO2 + Ba(OH)2 → BaCO3 + H2O (1)
2CO2 + Ba(OH)2 → Ba(HCO3)2 (2)
Ba(HCO3)2 \(\xrightarrow{{{t^o}}}\) BaCO3 + CO2 + H2O (3)
- Ta có: \({n_{{O_2}}} = \dfrac{{6,72}}{{22,4}} = 0,3(mol)\); \({n_{BaC{{\rm{O}}_3}(1)}} = \dfrac{{19,7}}{{197}} = 0,1(mol)\); \({n_{BaC{{\rm{O}}_3}(3)}} = \dfrac{{9,85}}{{197}} = 0,05(mol)\)
- Ta có nCO2 = nBaCO3(1) + 2nBa(HCO3)2 (2) = nBaCO3(1) + 2nBaCO3(3) = 0,2(mol)
Bước 2: Tính số mol H2O
\({m_{dd\,giam}} = {m_{BaC{{\rm{O}}_3}(1)}} - ({m_{C{O_2}}} + {m_{{H_2}O}})\)
\( \Leftrightarrow 5,5 = 19,7 - (44.0,2 + {m_{{H_2}O}}) \Rightarrow {m_{{H_2}O}} = 5,4(g)\)
\( \Rightarrow {n_{{H_2}O}} = \dfrac{{5,4}}{{18}} = 0,3(mol)\)
Bước 3: Xác định CTĐGN của X
- Bảo toàn nguyên tố C, H ta có:
\({n_C} = {n_{C{O_2}}} = 0,2(mol)\)
\({n_H} = 2{n_{{H_2}O}} = 2.0,3 = 0,6(mol)\)
- Bảo toàn nguyên tố O ta có: \({n_{O(X)}} + 2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}}\)
⟹ nO(X) + 2.0,3 = 2.0,2 + 0,3 ⟹ nO(X) = 0,1 mol.
- Gọi CTPT của X là CxHyOz
⟹ x : y : z = nC : nH : nO = 0,2 : 0,6 : 0,1 = 2 : 6 : 1
⟹ CTĐGN là C2H6O
Bước 4: Biện luận tìm CTPT của X
CTPT của X có dạng (C2H6O)n hay C2nH6nOn
Trong hợp chất hữu cơ chứa C, H, O ta luôn có: 0 < H ≤ 2C + 2 ⟹ 0 < 6n ≤ 2.2n + 2 ⟹ 0 < n ≤ 1 ⟹ n = 1
Vậy công thức phân tử của X là C2H6O.
Cho các chất sau: CH2=CH-CH2-CH2-CH=CH2; CH2=CH-CH=CH-CH2-CH3, CH3-C(CH3)=CH-CH3, CH2=CH-CH2-CH=CH2. Số chất có đồng phân hình học là
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Đáp án : C
Xem lại lí thuyết cấu trúc phân tử HCHC
Các chất có đồng phân hình học là
CH2=CH-CH=CH-CH2-CH3
Khi brom hóa một ankan chỉ thu được một dẫn xuất monobrom duy nhất có tỉ khối hơi đối với hiđro là 75,5. Tên của ankan đó là
-
A.
3,3-đimetylhexan.
-
B.
isopentan.
-
C.
2,2,3-trimetylpentan.
-
D.
2,2-đimetylpropan
Đáp án : D
+) Đặt CTPT của ankan là CnH2n+2
+) \({M_{{C_n}{H_{2n + 1}}Br}} = 75,5.\,\,\,\,2 = 151\,gam/mol\)
Gọi CTTQ của ankan là CnH2n+2
CnH2n+2 + Br2 → CnH2n+1Br + HBr
M dẫn xuất = 75,5 . 2 = 151
Ta có: 14n + 81 = 151 <=> n = 5
Ankan có CTPT là C5H12
C5H12 có 3 đồng phân:
C1H3 – C2H2 – C3H2 – C4H2 – C5H3 : có 3 vị trí thế Clo (1, 2, 3), vị trí C4 giống C2 và C5 giống C1
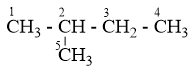
có 4 vị trí thế Clo (1, 2, 3, 4), vị trí C5 giống C1
(CH3)3C – CH3 : chỉ có 1 vị trí thế Clo vì 4 nhóm CH3 đều giống nhau
Hợp chất Y có công thức cấu tạo :
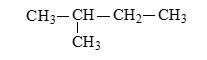
Y có thể tạo được bao nhiêu dẫn xuất monohalogen đồng phân của nhau ?
-
A.
3.
-
B.
4.
-
C.
5.
-
D.
6.
Đáp án : B
Xem lại lí thuyết phản ứng halogen hóa của ankan
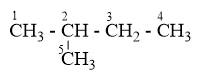
Ở vị trí C1 và C5 là giống nhau => có 4 vị trí thế monoclo là 1, 2 , 3, 4
=> có thể thu được 4 dẫn xuất halogen
Khi đốt cháy hoàn toàn 3,60g ankan X thu được 5,60 lít khí CO2 (ở đktc). Công thức phân tử của X là trường hợp nào sau đây?
-
A.
C3H8
-
B.
C5H10
-
C.
C5H12
-
D.
C4H10
Đáp án : C
Đặt công thức phân tử của ankan là CnH2n+2 có số mol là a mol
Từ số mol CO2 và khối lượng ankan ta tìm được a và n. Từ đó xác định được công thức phân tử của X.
Ta có: nCO2 = 0,25 mol
Đặt công thức phân tử của ankan là CnH2n+2 có số mol là a mol
Ta có: mankan X = a. (14n+2) = 3,60 gam; nCO2 = an = 0,25 mol
Suy ra a = 0,05; n = 5
Vậy công thức phân tử của ankan X là C5H12.
Crackinh 560 lít butan, xảy ra đồng thời các phản ứng:
\({C_4}{H_{10}} \to {H_2} + {C_4}{H_8}\)
\({C_4}{H_{10}} \to C{H_4} + {C_3}{H_6}\)
\({C_4}{H_{10}} \to {C_2}{H_6} + {C_2}{H_4}\)
Sau phản ứng thu được 896 lít hỗn hợp khí X. Thể tích C4H10 có trong hỗn hợp X là (các thể tích đo ở cùng điều kiện)
-
A.
336 lít
-
B.
168 lít
-
C.
280 lít
-
D.
224 lít
Đáp án : D
số mol khí tăng lên chính là lượng C4H10 đã phản ứng
Cứ 1 mol C4H10 cracking thì cho 2 mol khí => số mol khí tăng lên chính là lượng C4H10 đã phản ứng = 896 – 560 = 336 lít => thể tích C4H10 dư là 560 – 336 = 224 lít
Crackinh 8,8 gam propan thu được hỗn hợp A gồm H2, CH4, C2H4, C3H6 và một phần propan chưa bị crackinh. Biết hiệu suất phản ứng là 90%. Khối lượng phân tử trung bình của A là:
-
A.
39,6.
-
B.
23,16.
-
C.
2,315.
-
D.
3,96.
Đáp án : B
+) PTHH tổng quát: C3H8 → CmH2m+2 +CnH2n (n+m=2)
nsau pứ –= ntrước pứ +ncrackinh
+) msau = mtrước => M sau
n propan ban đầu = 0,2 mol ; npropan crackinh = 0,2.90:100 = 0,18 mol
PTHH cho phản ứng: C3H8 → CmH2m+2 +CnH2n (n+m=2)
ncrackinh → ncrackinh →ncrackinh
Ta có: nsau = ntrước + ncrackinh = 0,2 + 0,18 = 0,38 mol
BT khối lượng: msau = mtrước = 8,8 gam => M sau = 8,8/0,38 = 23,16
Đốt cháy hoàn toàn a gam hỗn hợp A gồm eten, propen, but-2-en cần dùng vừa đủ b lít khí oxi (ở đktc) thu được 2,4 mol CO2. Giá trị của b là
-
A.
92,4 lít
-
B.
94,2 lít.
-
C.
80,64 lít.
-
D.
24,9 lít.
Đáp án : C
- Đốt cháy anken thu được nCO2 = nH2O
- Tính b
Bảo toàn nguyên tố O: 2.nO2 = 2.nCO2 + nH2O => nO2
=> b
- Hỗn hợp A gồm các anken => đốt cháy thu được nCO2 = nH2O = 2,4 mol
- Bảo toàn nguyên tố O: 2.nO2 = 2.nCO2 + nH2O
=> nO2 = (2.2,4 + 2,4) / 2 = 3,6 mol
=> b = 3,6.22,4 = 80,64 lít
Cho 3,36 lít hỗn hợp etan và etilen (đktc) đi chậm qua qua dung dịch brom dư. Sau phản ứng khối lượng bình brom tăng thêm 2,8 gam. Số mol etan và etilen trong hỗn hợp lần lượt là:
-
A.
0,05 và 0,1.
-
B.
0,12 và 0,03.
-
C.
0,1 và 0,05.
-
D.
0,03 và 0,12.
Đáp án : A
Khối lượng bình brom tăng = khối lượng etilen phản ứng
Khối lượng bình brom tăng = khối lượng etilen phản ứng
=> m etilen = 2,8 gam => netilen = 2.8/28 = 0,1 mol
=> netan = 0,15 – 0,1 = 0,05
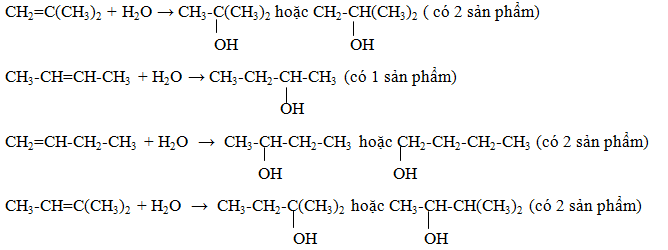
Anken khi tác dụng với nước cho duy nhất một ancol là
-
A.
CH2=C(CH3)2
-
B.
CH3-CH=CH-CH3
-
C.
CH2=CH-CH2-CH3
-
D.
CH3-CH=C(CH3)2
Đáp án : B
Viết sản phẩm phản ứng giữa từng chất với nước dựa vào quy tắc Maccopnhicop.
Hỗn hợp gồm 1 ankan (x mol) và 1 mol ankađien (x mol) đem đốt cháy hoàn toàn sẽ thu được
-
A.
\({n_{C{O_2}}} > {n_{{H_2}O}}\)
-
B.
\({n_{C{O_2}}} < {n_{{H_2}O}}\)
-
C.
\({n_{C{O_2}}} = {n_{{H_2}O}}\)
-
D.
\({n_{C{O_2}}} \ge {n_{{H_2}O}}\)
Đáp án : C
Gọi CT ankan là \({C_n}{H_{2n + 2}}\), CT của ankadien là \({C_m}{H_{2m - 2}}\)
Viết phương trình cháy của hai chất và tính số mol CO2 và H2O theo x,n,m.
Gọi CT ankan là \({C_n}{H_{2n + 2}}\), CT của ankadien là \({C_m}{H_{2m - 2}}\)
\(\begin{array}{l}{C_n}{H_{2n + 2}} + \dfrac{{3n + 1}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\\{C_m}{H_{2m - 2}} + \dfrac{{3m - 1}}{2}{O_2} \to mC{O_2} + (m - 1){H_2}O\\{n_{C{O_2}}} = n.{n_{{C_n}{H_{2n + 2}}}} + m.{n_{{C_m}{H_{2m - 2}}}} = nx + mx\\{n_{{H_2}O}} = (n + 1).{n_{{C_n}{H_{2n + 2}}}} + (m - 1).{n_{{C_m}{H_{2m - 2}}}} = (n + 1)x + (m - 1)x = nx + mx\\ \to {n_{C{O_2}}} = {n_{{H_2}O}}\end{array}\)
Hỗn hợp khí X gồm hai hiđrocacbon kế tiếp nhau trong dãy đồng đẳng. Oxi hóa hoàn toàn m gam hỗn hợp X, sản phẩm cháy cho đi qua bình (1) đựng dung dịch H2SO4 đặc. Bình (2) đựng dung dịch NaOH dư thì thấy khối lượng bình (1) tăng 9 gam và bình (2) tăng 30,8 gam. Phần trăm thể tích của hai khí là
-
A.
50% và 50%
-
B.
25% và 75%
-
C.
15% và 85%
-
D.
65% và 35%
Đáp án : A
+) \(\begin{gathered}{m_{{H_2}O}} = 9(gam);{m_{C{O_2}}} = 30,8(gam) \hfill \\\to \left\{ \begin{gathered}{n_{{H_2}O}} = 0,5(mol) \hfill \\{n_{C{O_2}}} = 0,7(mol) \hfill \\ \end{gathered} \right. \hfill \\\to {n_{C{O_2}}} > {n_{{H_2}O}} \hfill \\ \end{gathered} \)
=> CTPT của X là \({C_{\overline n }}{H_{2\overline n - 2}}\)
+) \(\begin{gathered}{n_X} = {n_{C{O_2}}} - {n_{{H_2}O}} = 0,2(mol) \hfill \\ \overline n = \frac{{{n_{C{O_2}}}}}{{{n_X}}} = 3,5 \hfill \\ \frac{{{n_{{C_3}{H_4}}}}}{{{n_{{C_4}{H_6}}}}} = \frac{{4 - 3,5}}{{3,5 - 3}} = \frac{1}{1} \hfill \\ \end{gathered} \)
Bình 1 hấp thụ H2O; bình 2 hấp thụ CO2
\(\begin{gathered}\to {m_{{H_2}O}} = 9(gam);{m_{C{O_2}}} = 30,8(gam) \hfill \\\to \left\{ \begin{gathered}{n_{{H_2}O}} = 0,5(mol) \hfill \\{n_{C{O_2}}} = 0,7(mol) \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} \)
Mà \({n_{C{O_2}}} > {n_{{H_2}O}}\) => gọi CTPT chung của 2 hidrocacbon là \({C_{\overline n }}{H_{2\overline n - 2}}\)
\(\begin{gathered}{n_X} = {n_{C{O_2}}} - {n_{{H_2}O}} = 0,2(mol) \hfill \\ \to \overline n = \frac{{{n_{C{O_2}}}}}{{{n_X}}} = 3,5 \hfill \\ \end{gathered} \)
Hai hidrocacbon là C3H4 và C4H6
\(\begin{gathered}\frac{{{n_{{C_3}{H_4}}}}}{{{n_{{C_4}{H_6}}}}} = \frac{{4 - 3,5}}{{3,5 - 3}} = \frac{1}{1} \hfill \\\to \% {V_{{C_3}{H_4}}} = \% {V_{{C_4}{H_6}}} = 50\% \hfill \\ \end{gathered} \)
Đốt cháy hoàn toàn m gam hidrocacbon ở thể khí, nhẹ hơn không khí, mạch hở thu được 7,04 gam CO2. Sục m gam hidrocacbon này vào nước brom dư đến phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng. Giá trị của m là
-
A.
3,02
-
B.
2,08
-
C.
3,06
-
D.
2,04
Đáp án : B
Đặt CTPT : CnH2n+2-2k ( k là số liên kết pi)
CnH2n+2-2k + k Br2 → CnH2n+2-2k Br2k
Bảo toàn C có nhc = \(\frac{{{n_{C{O_2}}}}}{n} = \frac{{0,16}}{n}\) mol → nBr2 = \(\frac{{0,16}}{n}.k\) = 0,16 → k = n → biện luận với n ≤ 4
Đặt CTPT : CnH2n+2-2k ( k là số liên kết pi)
CnH2n+2-2k + k Br2 → CnH2n+2-2k Br2k
Bảo toàn C có nhc = \(\dfrac{{{n_{C{O_2}}}}}{n} = \dfrac{{0,16}}{n}\) mol → nBr2 = \(\dfrac{{0,16}}{n}.k\) = 0,16 → k = n → Hidrocacbon là CnH2
Với k = n = 1 thì HC là : CH2 loại
Với k = n = 2 thì HC là C2H2 → m = 0,08 . 26 =2,08 g
Với k = n = 3 thì HC là C3H2 ( không có CTHH thỏa mãn )
Với k = n =4 thì HC là C4H2 → m = 0,04.50 = 2 g
Dẫn 17,4 gam hỗn hợp khí X gồm propin và but-2-in lội thật chậm qua bình đựng dung dịch AgNO3/NH3 dư thấy có 44,1 gam kết tủa xuất hiện. Phần trăm thể tích của mỗi khí trong X là
-
A.
C3H4 80% và C4H6 20%
-
B.
C3H4 25% và C4H6 75%
-
C.
C3H4 75% và C4H6 25%
-
D.
kết quả khác
Đáp án : C
nkết tủa = nankin; ank-1-in mới tạo kết tủa với AgNO3/NH3
Chỉ có propin tạo kết tủa với AgNO3/NH3 => npropin = nC3H3Ag =\(\dfrac{{44,1}}{{147}}\) = 0,3 mol
=> mC3H4 = 12 gam => mC4H6 = 5,4 gam => nC4H6 = 0,1 mol
=> %VC3H4 = 75%; %VC4H6 = 25%
Phân biệt các chất metan, etilen, axetilen bằng phương pháp hóa học, ta dùng
-
A.
dd AgNO3/NH3 và nước brom.
-
B.
dung dịch AgNO3/NH3
-
C.
dd NaOH.
-
D.
dd KMnO4
Đáp án : A
|
|
Metan (CH4) |
Etilen (CH2 = CH2) |
Axetilen (CH º CH) |
|
AgNO3/NH3 |
x |
x |
↓ vàng |
|
dung dịch Br2 |
x |
mất màu |
|
Phương trình hóa học
CH≡CH + 2AgNO3 + 2NH3 → Ag–C≡C–Ag ↓(vàng) + 2NH4NO3
CH2=CH2 + Br2 → CH2Br–CH2Br
Nung nóng a mol hỗn hợp X gồm C2H2 và H2 trong bình kín có xúc tác thích hợp thu được hỗn hợp khí Y. Dẫn Y qua lượng dư dung dịch AgNO3 trong NH3, sau khi phản ứng hoàn toàn thu được 24 gam kết tủa và hỗn hợp khí Z. Hỗn hợp Z làm mất màu tối đa 40 gam brom trong dung dịch và còn lại hỗn hợp khí T. Đốt cháy hoàn toàn hỗn hợp T thu được 11,7 gam nước. Giá trị của a là:
-
A.
1,00.
-
B.
0,80.
-
C.
1,50.
-
D.
1,25.
Đáp án : D
+) Trong Y có C2H2, tạo kết tủa Ag2C2 $\Rightarrow {{n}_{{{C}_{2}}{{H}_{2}}}}$
Z làm mất màu dung dịch Br2 => Z chứa C2H4 $=>{{n}_{{{C}_{2}}{{H}_{4}}}}={{n}_{B{{\text{r}}_{2}}}}$
Còn lại hỗn hợp khí T gồm C2H6 và H2
${{n}_{{{H}_{2}}O}}=3.{{n}_{{{C}_{3}}{{H}_{6}}}}+{{n}_{{{H}_{2}}}}$ dư
${{n}_{{{C}_{2}}{{H}_{2}}}}$ bđầu $={{n}_{{{C}_{2}}{{H}_{2}}\text{ }du}}+\text{ }{{n}_{{{C}_{2}}{{H}_{4}}}}+\text{ }{{n}_{{{C}_{2}}{{H}_{6}}}}$
${{n}_{{{H}_{2}}}}$ ban đầu $={{n}_{{{H}_{2}}\text{ }du}}+{{n}_{{{C}_{2}}{{H}_{4}}}}+2.{{n}_{{{C}_{2}}{{H}_{6}}}}$
Cộng 2 vế phương trình ta có:
$~a={{n}_{{{C}_{2}}{{H}_{2}}\text{ }du}}+2.{{n}_{{{C}_{2}}{{H}_{4}}}}+3.{{n}_{{{C}_{2}}{{H}_{6}}}}+{{n}_{{{H}_{2}}}}_{du}~$ => a
C2H2 + 2H2 → C2H6
C2H2 + H2 → C2H4
Trong Y có C2H2, tạo kết tủa Ag2C2 => ${{n}_{A{{g}_{2}}{{C}_{2}}}}=0,1\,mol$
$\Rightarrow {{n}_{{{C}_{2}}{{H}_{2}}(Y)}}=0,1\,mol$
Z làm mất màu dung dịch Br2 => Z chứa C2H4
$=>{{n}_{{{C}_{2}}{{H}_{4}}}}={{n}_{B{{\text{r}}_{2}}}}=0,25\,mol$
Còn lại hỗn hợp khí T gồm C2H6 và H2
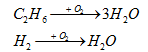
=> ${{n}_{{{H}_{2}}O}}=3.{{n}_{{{C}_{3}}{{H}_{6}}}}+{{n}_{{{H}_{2}}}}$ dư = 0,65 (1)
Bảo toàn nguyên tố C ta có: ${{n}_{{{C}_{2}}{{H}_{2}}}}$ bđầu $={{n}_{{{C}_{2}}{{H}_{2}}\text{ }du}}+\text{ }{{n}_{{{C}_{2}}{{H}_{4}}}}+\text{ }{{n}_{{{C}_{2}}{{H}_{6}}}}$
${{n}_{{{H}_{2}}}}$ ban đầu $={{n}_{{{H}_{2}}\text{ }du}}+{{n}_{{{C}_{2}}{{H}_{4}}}}+2.{{n}_{{{C}_{2}}{{H}_{6}}}}$
Cộng 2 vế phương trình ta có:
$~a={{n}_{{{C}_{2}}{{H}_{2}}\text{ }du}}+2.{{n}_{{{C}_{2}}{{H}_{4}}}}+3.{{n}_{{{C}_{2}}{{H}_{6}}}}+{{n}_{{{H}_{2}}}}_{du}~$
Thay (1) vào => a = 0,1 + 0,25.2 + 0,65 = 1,25
Cho 0,25 mol hỗn hợp X gồm axetilen và một hiđrocacbon Y có tỉ lệ mol 1 : 1 vào dung dịch AgNO3/NH3 dư thu được 63 gam kết tủa vàng. Công thức phân tử hiđrocacbon Y là
-
A.
CH3CH2CH2-C≡CH
-
B.
CH3-CH2-C≡CH
-
C.
CH≡C-CH≡C-CH3
-
D.
CH≡C–C≡CH
Đáp án : D
+) Xét Y có tạo kết tủa với dd AgNO3/NH3 không
+) Tính số mol kết tủa theo PT: CxHy → CxHy-aAga (a ≥ 1)
+) Từ ${m_{{C_x}{H_{y - a}}A{g_a}}}\, \to \,{M_{{C_x}{H_{y - a}}A{g_a}}}$
+) Giả sử kết tủa chứa 1 Ag → CxHy-1Ag
+) Giả sử kết tủa chứa 2 Ag → CxHy-2Ag2
${n_{{C_2}{H_2}}}\,\, = \,\,{n_Y}\,\, = \,\,\frac{{0,25}}{2}\,\, = \,\,0,125\,\,mol$
C2H2 → C2Ag2
0,125 → 0,125
${m_{{C_2}A{g_2}}}\,\, = \,\,0,125.240\,\, = \,\,30\,\,gam\,\, < \,\,63\,\,gam$→ Y cũng tạo kết tủa với AgNO3/NH3
→ Y có liên kết ba đầu mạch.
Y: CxHy
CxHy → CxHy-aAga (a ≥ 1)
0,125 → 0,125
${m_{{C_x}{H_{y - a}}A{g_a}}}\,\, = \,\,63\,\, - \,\,30\,\, = \,\,33\,\,gam\,\, \to \,\,{M_{{C_x}{H_{y - a}}A{g_a}}}\,\, = \,\,\frac{{33}}{{0,125}}\,\, = \,\,264$
→ Y chứa tối đa 2 liên kết ba đầu mạch
Giả sử kết tủa chứa 1 Ag → CxHy-1Ag → 12x + y – 1 + 108 = 264 → 12x +y = 157 → MY = 157 (lẻ) → loại
Giả sử kết tủa chứa 2 Ag → CxHy-2Ag2 → 12x + y – 2 + 2.108 = 264 → 12x + y = 50 → MY = 50 (chẵn)
=> x = 4; y = 2 → Y là CH≡C–C≡CH
Cho hỗn hợp X gồm: etan, propilen, benzen, metylaxetat, axit propanoic. Đốt cháy hoàn toàn m gam hỗn hợp X cần dùng 4,592 lít (đktc) khí O2 thu được hỗn hợp sản phẩm. Cho toàn bộ sản phẩm cháy vào 100 ml dung dịch Ca(OH)2 1M thu được 5 gam kết tủa và một muối của canxi. Sau phản ứng thấy khối lượng dung dịch tăng 4,3 gam. Phần trăm số mol của hỗn hợp (metyl axetat, axit propanoic) trong X là:
-
A.
60 %
-
B.
12,22 %
-
C.
87,78 %
-
D.
40 %
Đáp án : D
+) Từ số mol Ca(OH)2 và số mol kết tủa CaCO3 => tính số mol CO2 sinh ra
+) $\Delta {{m}_{\tan g}}={{m}_{C{{O}_{2}}}}+{{m}_{{{H}_{2}}O}}-{{m}_{CaC{{\text{O}}_{3}}}}\Rightarrow {{n}_{{{H}_{2}}O}}$
+) BTNT O: => nO (trong X)
+) Ta thấy các chất trong X đều có 6H => nX
${{n}_{Ca}}=0,1\,mol\xrightarrow{BTNT\,Ca}\left\{ \begin{align}& {{n}_{Ca{{(HC{{O}_{3}})}_{2}}}}=0,05\,mol \\& {{n}_{CaC{{\text{O}}_{3}}}}=0,05\,mol \\\end{align} \right.\xrightarrow{BTNT\,C}{{n}_{C{{O}_{2}}}}={{n}_{C}}=0,15\,mol$.
$\Delta {{m}_{\tan g}}={{m}_{C{{O}_{2}}}}+{{m}_{{{H}_{2}}O}}-{{m}_{CaC{{\text{O}}_{3}}}}\Rightarrow {{m}_{{{H}_{2}}O}}=2,7\,gam\Rightarrow {{n}_{{{H}_{2}}O}}=0,15\,mol$
BTNT O: nO (trong X) + 0,205.2 = 0,15.2 + 0,15 => nO (trong X) = 0,04 mol
Ta thấy các chất trong X đều có 6H
=> ${n_X} = \frac{{0,15.2}}{6} = 0,05{\mkern 1mu} mol{\mkern 1mu} \to \% {n_{hh}} = \frac{{0,02}}{{0,05}}.100\% = 40\% $
Đốt cháy 13,7 ml hỗn hợp A gồm metan, propan và cacbon (II) oxit, ta thu được 25,7 ml khí CO2 ở cùng điều kiện nhiệt độ và áp suất. Thành phần % thể tích propan trong hỗn hợp A và khối lượng phân tử trung bình của hỗn hợp A so với nitơ là :
-
A.
6% ; bằng 1.
-
B.
6 % ; nhỏ hơn 1.
-
C.
6 % ; lớn hơn 1.
-
D.
94 % ; nhỏ hơn 1.
Đáp án : C
CH4 CO2 (1) ; C3H8 3CO2 (2) ; CO CO2 (3)
x x y 3y z z
Từ (1), (2), (3) và giả thiết ta có hệ :
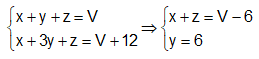
+) \({\overline M _A} = \dfrac{{16x + 44y + 28z}}{{x + y + z}} => \dfrac{{16(x + z) + 44y}}{{x + y + z}}\)
Mặt khác
\({M_{{N_2}}} = 28\,\,gam/mol\) nên suy ra khối lượng phân tử trung bình của A lớn hơn so với N2 hay \(\dfrac{{\overline M {}_A}}{{{M_{{N_2}}}}} > 1.\)
Đặt số mol của metan, propan và cacbon (II) oxit lần lượt là x, y, z
Sơ đồ phản ứng :
CH4 CO2 (1) ; C3H8 3CO2 (2) ; CO CO2 (3)
x x y 3y z z
Từ (1), (2), (3) và giả thiết ta có hệ :
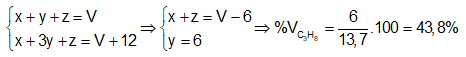
Khối lượng mol trung bình của hỗn hợp A là :
\({\overline M _A} = \dfrac{{16x + 44y + 28z}}{{x + y + z}} > \dfrac{{16(x + z) + 44y}}{{x + y + z}} = \dfrac{{16.7,7 + 44.6}}{{13,7}} = 28,3\,\,gam/mol\)
Mặt khác
\({M_{{N_2}}} = 28\,\,gam/mol\) nên suy ra khối lượng phân tử trung bình của A lớn hơn so với N2 hay \(\dfrac{{\overline M {}_A}}{{{M_{{N_2}}}}} > 1.\)
Đốt cháy hoàn toàn hỗn hợp A (gồm 2 ankin X và Y, số mol của X gấp 1,5 lần số mol của Y). Hấp thụ toàn bộ sản phẩm cháy vào cốc đựng 4,5 lít dd Ca(OH)2 0,02M thu được m1 gam kết tủa và khối lượng dung dịch tăng 3,78 gam. Thêm dung dịch Ba(OH)2 vừa đủ vào cốc, thu được thêm m2 gam kết tủa nữa. Biết m1 + m2 = 18,85 gam. X, Y lần lượt là
-
A.
C3H4 và C4H6.
-
B.
C2H2 và C4H6.
-
C.
C2H2 và C3H4.
-
D.
C4H6 và C2H2.
Đáp án : B
Vì thêm Ba(OH)2 vào cốc thu được thêm kết tủa => CO2 tác dụng với Ca(OH)2 tạo 2 muối CaCO3 và Ca(HCO3)2
+) nCa(OH)2 = PT (1)
+) Vì m1 + m2 = 18,85 => PT (2)
+) mdung dịch tăng = mCO2 + mH2O - mkết tủa
+) nankin = nH2O – nCO2
Gọi CTPT của X là CnH2n-2 (0,03 mol) và Y là CmH2m-2 (0,02 mol)
+) Bảo toàn nguyên tố C: nCO2 = 0,03n + 0,02m
nCa(OH)2 = 0,09 mol
Vì thêm Ba(OH)2 vào cốc thu được thêm kết tủa => CO2 tác dụng với Ca(OH)2 tạo 2 muối CaCO3 và Ca(HCO3)2
CO2 + Ca(OH)2 → CaCO3 + H2O
x → x → x
2CO2 + Ca(OH)2 → Ca(HCO3)2
2y → y → y
=> nCa(OH)2 = x + y = 0,09 (1)
Ca(HCO3)2 + Ba(OH)2 → CaCO3 + BaCO3 + 2H2O
y → y → y → y
Vì m1 + m2 = 18,85 => 100x + 100y + 197y = 18,85 (2)
Từ (1) và (2) => x = 0,04 và y = 0,05
=> nCO2 = x + 2y = 0,04 + 2.0,05 = 0,14 => m CO2 = 6,16 gam
mdung dịch tăng = mCO2 + mH2O - mkết tủa = 3,78 gam
=> mH2O = 3,78 + 100.0,04 – 6,16 = 1,62 gam => nH2O = 0,09 mol
=> nankin = nH2O – nCO2 = 0,14 – 0,09 = 0,05 mol
Theo đầu bài: nX = 1,5 nY => nX = 0,03 mol; nY = 0,02 mol
Gọi CTPT của X là CnH2n-2 (0,03 mol) và Y là CmH2m-2 (0,02 mol)
Bảo toàn nguyên tố C: nCO2 = 0,03n + 0,02m = 0,14
=> 3n + 2m = 14
|
m |
2 |
3 |
4 |
5 |
|
n |
10/3 (loại) |
8/3 (loại) |
2 (TM) |
4/3 (loại) |
=> 2 ankin X và Y lần lượt là C2H2 và C4H6
Các bài khác cùng chuyên mục
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 3
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 7+8: Hidrocacbon thơm và Ancol - Phenol - Ete - Đề số 1
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 3
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 2
- Đề kiểm tra 1 tiết Hóa 11 chương 5+6: Hidrocacbon no và hidrocacbon không no - Đề số 1

















